
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | S02 | Ⅱ | 良 |
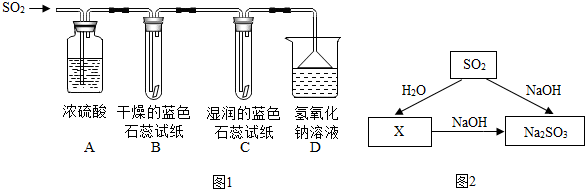
分析 实验一:(1)根据浓硫酸能够吸水做干燥剂进行解答;
(2)根据酸遇酸碱指示剂变色情况进行解答;
(3)根据二氧化硫的性质以及污染空气进行解答;
实验二:根据溶液的酸碱性与pH的关系进行解答,当溶液的pH<7显酸性,当溶液的pH=7显中性,当溶液的pH>7显碱性;
【查阅资料】:根据催化剂的作用进行解答;
【模拟实验】:(1)根据醋酸和大理石反应生成醋酸钙进行解答;
(2)控制实验条件进行对比实验;
【知识联想】:根据二氧化硫和水反应生成亚硫酸以及亚硫酸的性质进行解答.
解答 解:实验一:(1)浓硫酸能够吸水做干燥剂,A装置的作用是干燥二氧化硫气体;
(2)酸遇到蓝色石蕊试纸变红色,说明S02与水反应生成了亚硫酸;
(3)二氧化硫任意排放会造成酸雨,为了防止污染空气,用氢氧化钠溶液吸收;反应的化学方程式是SO2+2NaOH═Na2SO3+H2O;
实验二:当溶液的pH<7显酸性,当溶液的pH=7显中性,当溶液的pH>7显碱性,S02与水反应生成了亚硫酸,溶液显酸性,所以溶液的pH<7;
【查阅资料】:SO2与空气中的O2在飘尘的作用下反应生成S03,而飘尘的质量和性质在反应前后不发生变化,说明此过程中飘尘作催化剂;
【模拟实验】:(1)醋酸和大理石反应生成醋酸钙、水和二氧化碳,醋酸钙易溶于水,所以最后固体的质量小于0.2g;
(2)因为食醋含有水,所以另外增加大理石碎片放在蒸馏水中,这样做一个对比实验,证明对大理石起腐蚀作用的是醋酸而不是水;
【知识联想】:二氧化硫和水反应生成亚硫酸,X的化学式是H2SO3,亚硫酸和氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式是H2SO3+2NaOH═Na2SO3+2H2O,此反应属于复分解反应.
故答案为:实验一:(1)干燥;
(2)酸;
(3)吸收SO2,防止污染空气;SO2+2NaOH═Na2SO3+H2O;
实验二:<;
【查阅资料】:催化剂;
【模拟实验】:(1)A;
(2)与实验(1)作对照,证明对大理石起腐蚀作用的是醋酸而不是水;
【知识联想】:H2SO3,H2SO3+2NaOH═Na2SO3+2H2O.
点评 解答本题的关键是要掌握化学方程式的书写方法以及二氧化硫对空气的污染和二氧化硫的吸收,只有这样才能对问题做出正确的判断.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验数据 | 反应前 | 反应后 | |
| 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和反应后混合物的质量 | |
| 300g | 24g | 315.2g | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO 有可燃性和还原性 | |
| B. | CO 可用排水集气法收集 | |
| C. | CO 有毒,能跟血红蛋白结合,使人体缺氧 | |
| D. | CO 可用向上排空气法收集 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水和过氧化氢的化学性质不同,是因为这两种物质的分子构成不同 | |
| B. | CO2使紫色石蕊试液变红,是因为CO2分子能与紫色石蕊发生化学反应 | |
| C. | 哇哈哈富氧水能够补氧,是因为富氧水里溶有氧气分子 | |
| D. | 高山上喝空的矿泉水瓶,抒紧瓶盖,下山后瓶子变瘪,是因为瓶内的气体分子变小 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象I | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| A取少量样品溶于水,加入过量的CaCl2溶液 | ①有白色沉淀产生 | 该反应的方程式:②Na2CO3+CaCl2═CaCO3↓+2NaCl |
| B将上述反应后的混合液过滤,取滤液③滴加稀盐酸 | ④有气泡冒出 | 证明猜想②成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com