
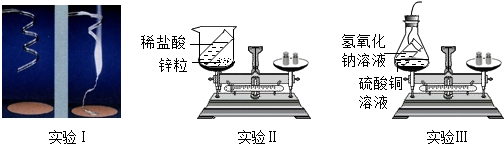
| 编号 | 实验I | 实验II | 实验III |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
分析 【提出假设】依据质量守恒定律的定义进行猜想.
(1)从反应物和生成物的状态分析,不要忽略气体物质的质量,镁和氧气反应时,氧气也有质量;
(2)锌和稀盐酸反应生成气体,固体也会逐渐减少;
(3)依据题目中的信息找准反应物、生成物及反应条件书写反应的化学方程式,注意配平和沉淀符合.
(4)用质量守恒定律的微观实质进行解释,反应前后原子不发生改变.
(5)改进思路:称量时保证所有反应物和生成物都称量在内,没有遗漏.可以选择无气体参与或生成的反应,也可将有气体参与或生成的反应置于密闭容器中进行.
解答 解:【提出假设】物质发生化学反应前后,其总质量 相等;
(1)根据质量守恒定律,参加反应的镁带和氧气的质量总和,等于反应后生成的氧化镁的质量,由于空气中的氧气参与了反应,因此,生成氧化镁的质量比原来镁带的质量增加了
(2)反应物为锌和盐酸,生成物为氯化锌和氢气,故反应现象是锌粒溶解,有气泡冒出.
(3)根据反应物生成物,依据质量守恒定律书写化学方程式.
(4)化学反应的过程实质是分子分为原子,原子重新组合成新分子的过程,原子是化学变化中的最小微粒,不可再分.(5)实验I、II不能正确反映反应物和生成物之间的质量关系是因为反应中有气体参与或生成,在实验时没有把这些气体称量在内,改进时,可以选择无气体参与或生成的反应,也可将有气体参与或生成的反应置于密闭容器中进行.
故答案是:相等(或不变);
(1)根据质量守恒定律,参加反应的镁带和氧气的质量总和,等于反应后生成的氧化镁的质量,由于空气中的氧气参与了反应,因此,生成氧化镁的质量比原来镁带的质量增加了;
(2)锌粒逐渐溶解,并有气泡冒出;
(3)2NaOH+CuSO4═Na2SO4+Cu(OH)2↓;
(4)化学反应前后原子的种类、数目和质量没有发生改变.
(5)实验I应将镁条放在密闭的金属容器中引燃,再称量.
点评 该题通过三个实验探究质量守恒定律,旨在考查对质量守恒定律定义的理解、对质量守恒定律的微观解释,通过该题加深了“参加”、“总质量”的认识、质量守恒定律的微观意义.


科目:初中化学 来源: 题型:选择题
| A. | 二氧化锰没有参与化学反应 | B. | 与高锰酸钾制取氧气装置相同 | ||
| C. | 可用向上排空气法收集 | D. | 可用带火星的木炭检验氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A:化学常识 ①空气的主要成分--氮气和氧气 ②硬水和软水--可用肥皂水来检验 | B:实验中玻璃棒的作用 ①溶解时搅拌,加速溶解 ②过滤时起到引流的作用 |
| C:由电解水实验可得到的结论 ①水中含有氢分子和氧分子 ②水由氢、氧元素组成 ③分子在化学反应中可以再分 | D:化学与能源 ①沼气、酒精--生物能源,可再生能源 ②石油、煤--化石能源,不可再生能源 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 现象 | 结论 |
| 取少量石蕊试液于试管中,逐滴加入反应后烧杯内的溶液. | 溶液变红 | 猜想3正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧分子 | B. | 氧离子 | ||
| C. | 相同的化合价的氧元素 | D. | 氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 钠原子失去电子后变成钠离子 | B. | 氯离子失去电子后不能变成氯原子 | ||
| C. | 原子的质量主要集中在原子核上 | D. | 化学变化中原子不能再分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com