
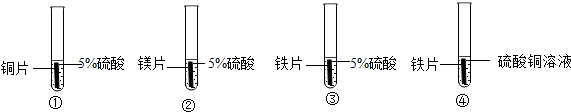
| 装置编号 | 实验现象 |
| ① | 金属表面无明显现象 |
| ② | 剧烈反应,金属表面产生大量无色气泡,每片逐渐溶解 |
| ③ |
分析 本题首先指出金属铜的导电性,体现了性质决定用途.还要记住铁生锈的条件:铁在潮湿的空气中易生锈;以及炼铁的原料和反应的原理.然后考查了利用控制变量法,设计实验来验证金属的活动性.实验a中改变的是不同的金属,其它量不变,由实验现象镁片表面的气泡又多又快,得出镁比铁活泼.b中将铜片放入到硝酸银溶液中,会看到铜片表面有黑色物质;要证明四种金属的活泼性,还需要设计一个实验,证明铁比铜活泼.
根据铜镁铁的金属活动性顺序来解答该题,其中在能够反应的前提下,活动性越强产生的气泡越多,可以据此答题;
证明铁和铜的活动顺序,要比较铁的性质比铜活泼,只要用铜的盐溶液即可,所以将铁放入硫酸铜溶液中,则会在铁的表面形成红色物质,同时溶液变为浅绿色,根据铁的质量结合化学方程式可以求算出铜的质量.
解答 解:(1)铜的导电性居第二位,被用作电线和各种电器的制作.故答案为:导电性,用作电线;
(2)铁在潮湿的空气中易生锈,因此是铁与氧气和水同时接触.故答案为:铁制品与空气(氧气)和水同时接触;
(3)炼铁的固体原料有铁矿石、石灰石和焦炭,氧化铁与一氧化碳反应生成铁和二氧化碳,要注意化学式的书写和配平.故答案为:焦炭;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)将镁放入硫酸中,会产生大量的气泡,反应速率较快,而铁的表面会产生气泡,但是速率相对较慢,根据金属与酸反应时活动性越强,反应的现象越剧烈,可以得出这三种金属的活动性顺序为:Mg>Fe>Cu,为了使反应结论更准确,所以应该保证稀硫酸的溶质质量分数相同;
(5)铁的性质比铜活泼,所以将铁放入硫酸铜溶液中,则会在铁的表面形成红色物质,同时溶液变为浅绿色,该反应的化学方程式为:Fe+CuSO4═Cu+FeSO4;
答案:
(1)导电性,用作电线;
(2)铁制品与空气(氧气)和水同时接触;
(3)焦炭;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)金属表面有少量气泡产生,速率较慢;
金属活动性顺序为Mg>Fe>Cu;使反应结论更准确;
(5)在铁的表面形成红色物质,同时溶液变为浅绿色;Fe+CuSO4═Cu+FeSO4;
点评 本考点中既有金属性质的应用,又有化学方程式的书写和实验过程的探究和评价,考查的比较全面,只要认真分析,问题就不难解决.金属的活动性顺序是中考的热点内容,本题既考查了实验现象的描述、又考查了学生的实验设计能力,还与生活实际相联系,综合性比较强.本考点经常出现在实验题中,同学们要认真掌握.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 地壳中含量最高的金属元素是铝 | |
| B. | 金属材料包含纯金属及其合金 | |
| C. | 导电性和导热性最好的金属是银 | |
| D. | 合金是通过熔合而形成的,固它们的形成发生了化学反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸能使紫色石蕊试液变红,紫色石蕊试液中通入CO2后变红,故CO2是酸 | |
| B. | 酸性溶液的pH小于7,食醋呈酸性,故食醋的pH小于7 | |
| C. | 在同一化合物中,金属元素显正价,故非金属元素一定显负价 | |
| D. | 改变条件,使溶液中有晶体析出,溶质质量减少,故溶液的质量分数一定减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
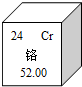 2012年4月15日,央视《每周质量报告》对“非法厂商用皮革下脚料造药用胶囊”曝光,其制成的胶囊往往重金属铬超标.
2012年4月15日,央视《每周质量报告》对“非法厂商用皮革下脚料造药用胶囊”曝光,其制成的胶囊往往重金属铬超标.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com