
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
| 物质 | 有利的一面(用途) | 不利的一面 |
| 示例:CO2 | 灭火,人工降雨等 | 全球气候变暖 |
| O2 | 供给呼吸 | 使金属氧化锈蚀 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2↑+O2↑ | B. | BaCl2+Na2SO4=BaSO4↓+2NaCl | ||
| C. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | D. | 2Fe+3HCl=2FeCl3+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
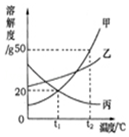 如图是甲、乙、丙三种物质的溶解度曲线.
如图是甲、乙、丙三种物质的溶解度曲线. 查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 样品成分 | 所选试剂 | 实验操作 |
| A | CO2(CO) | 氧气 | 点燃 |
| B | FeCl2溶液(CuCl2) | 铁粉 | 加过量的铁粉,充分搅拌后过滤 |
| C | Fe(Cu) | 稀盐酸 | 充分反应后过滤、洗涤、干燥 |
| D | KCl(MnO2) | 水 | 溶解、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
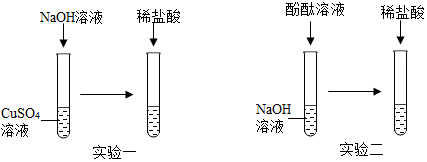
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
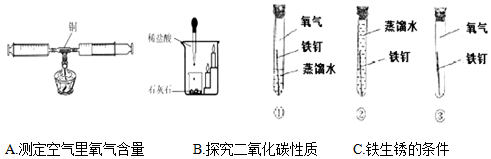
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com