
| A. | 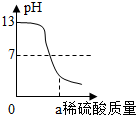 将锌片插入盛有一定量稀硫酸的烧杯中 将锌片插入盛有一定量稀硫酸的烧杯中 | |
| B. | 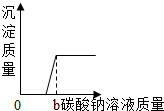 向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| C. | 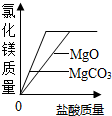 向足量碳酸镁和氧化镁固体中分别加入相同质量、相同质量分数稀盐酸中 向足量碳酸镁和氧化镁固体中分别加入相同质量、相同质量分数稀盐酸中 | |
| D. | 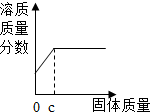 向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 |
分析 A、根据锌与稀硫酸的反应分析溶液质量的变化;
B、向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液,碳酸钠先与盐酸反应,反应完后再与氯化钙反应,据此分析;
C、根据当向固体中加入盐酸时,在固体没有反应完全之前,生成氯化镁的质量取决于盐酸的质量,因此开始应该是重合的.由于固体是足量的,盐酸是等质量所以最终得到氯化镁应该是一样多.
D、根据稀盐酸与NaOH溶液的反应分析溶液PH的变化
解答 解:A、将锌片插入盛有一定量稀硫酸的烧杯中,反应前稀硫酸显酸性,pH值应小于7,pH值为13.故A图象错误;
B、向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液,碳酸钠先与盐酸反应,不产生沉淀,反应完后再与氯化钙反应产生沉淀,氯化钙完全反应后,再加入碳酸钠,沉淀不再增加,故B图象正确;
C、当向固体中加入盐酸时,在固体没有反应完全之前,生成氯化镁的质量取决于盐酸的质量,因此开始应该是重合的.由于固体是足量的,盐酸是等质量所以最终得到氯化镁应该是一样多.故C图象错误;
D、向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量,溶液中氯化钠的质量开始时不断增大,当盐酸完全反应后,再加入NaOH溶液,氯化钠的量不再增加.故D图象正确.
故选A.
点评 此题是过程与图象结合题,是对学生识图能力的考查,解题的关键是能正确的分析各个反应的过程,并结合图象分析问题,对培养学生分析问题的能力有一定帮助.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A | 金刚石、石墨的物理性质相差很大 | 因为其原子的排列方式不同 |
| B | 氢氧化钠溶液、碳酸钠溶液、氨水都能使酚酞变红 | 因为都是碱溶液 |
| C | 人需要从食物中摄取维生素 | 是为生命活动提供能量 |
| D | 用灯帽盖灭酒精灯和用嘴吹灭蜡烛 | 都将燃烧着的可燃物与空气隔绝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加热时间 (小时) | 焦谷氨酸钠含量(%) | ||
| 100℃ | 107℃ | 115℃ | |
| 0.5 | 0.3 | 0.4 | 0.7 |
| 1.0 | 0.6 | 0.9 | 1.4 |
| 2.0 | 1.1 | 1.9 | 2.8 |
| 4.0 | 2.1 | 3.6 | 5.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 火是推动人类文明进步的重要因素,使用不当时可能成为吞噬生命的恶魔.请回答下列问题;
火是推动人类文明进步的重要因素,使用不当时可能成为吞噬生命的恶魔.请回答下列问题;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com