
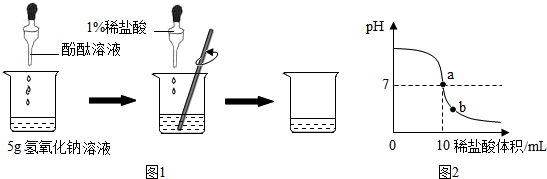
分析 (1)①根据酚酞遇碱性溶液变红,可以用来检验酸碱是否发生中和反应;
②根据盐酸与氢氧化钠反应分析回答;
③根据氢氧化钠与盐酸的反应,由盐酸溶质的质量求出氢氧化钠的质量,再求出氢氧化钠溶液中溶质的质量分数;
(2)①根据pH试纸使用方法分析判断;
②根据溶液pH的变化图象的意义,分析a的含义、b点溶液中的阳离子;由盐酸的体积和密度可求出盐酸的质量.
(3)根据氢氧化钠与二氧化碳的反应写出氢氧化钠变质的方程式,根据碳酸钠的性质分析设计除去碳酸钠的实验方案.
解答 解:(1)①酚酞遇碱性溶液变红,酚酞溶液的作用是:判断反应是否恰好完成;
②在中和反应过程中,边滴加稀盐酸,随着氢氧化钠逐渐减少至消失,溶液由红色液体变成无色;
③盐酸中溶质的质量为:7.3g×1%=0.073g
设氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 0.073g
$\frac{40}{x}=\frac{36.5}{0.073g}$
得:x=0.08g
甲组这瓶氢氧化钠溶液中溶质的质量分数为:$\frac{0.08g}{5g}$×100%=1.6%
(2)①A.将pH试纸剪成几段节约使用,方法正确;
B.将pH试纸直接插入待测液中,会污染试剂,方法错误;
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上,方法正确;
D.将pH试纸润湿后,会使碱液变稀,碱性变弱,故测得碱液的pH偏小,方法错误;
②由溶液pH的变化图象可知,在a点时,溶液的pH等于7,说明了氢氧化钠和盐酸恰好中和;在b点时,溶液呈酸性,氢氧化钠全部与盐酸反应生成了氯化钠,溶液中还有剩余的盐酸.所以溶液中的阳离子是:Na+、H+;要求氢氧化钠溶液的质量质量分数,须知盐酸的质量,由题中的条件可知,还需要的数据是稀盐酸的密度.
(3)氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,反应的方程式是:CO2+2NaOH=Na2CO3+H2O.由于碳酸钠能与氢氧化钙反应生成了氢氧化钠和碳酸钙,既除去了杂质碳酸钠,又没有引入新的杂质.所以,要除去溶液中变质生成的杂质,实验方案是:加适量澄清石灰水,过滤.
故答为:(1)①判断反应是否恰好完成;②溶液由红色液体变成无色;③1.6%;
(2)①AC;②恰好中和或恰好完全反应;Na+、H+;稀盐酸的密度.
(3)CO2+2NaOH═Na2CO3+H2O; 加适量澄清石灰水(或氢氧化钡溶液),过滤.
点评 本题是考查中和反应过程中溶液pH的变化情况的,我们要知道向酸中加碱和向碱中加酸时,溶液pH的变化趋向.明确不同指示剂的变色范围.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:初中化学 来源: 题型:填空题
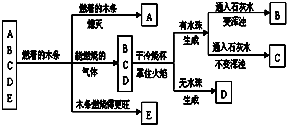 有A、B、C、D、E五种气体,它们分别是氧气、氢气、一氧化碳、二氧化碳、甲烷中的一种,对其进行如下图所示的实验:
有A、B、C、D、E五种气体,它们分别是氧气、氢气、一氧化碳、二氧化碳、甲烷中的一种,对其进行如下图所示的实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeCl3 NaOH KCl | B. | KCl Na2CO3 Na2SO4 | ||
| C. | BaCl2 NaCl Na2SO4 | D. | NaCl AgNO3 KCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
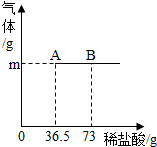 为测定某纯碱(Na2CO3)样品中(含有少量的NaCl杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸(Na2CO3+2HCl═2NaCl+H2O+CO2↑),当稀盐酸滴加至36.5g时(烧杯内不再产生气体为止),烧杯内溶液的总质量为40.3g(产生的气体全部逸出).试计算:
为测定某纯碱(Na2CO3)样品中(含有少量的NaCl杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸(Na2CO3+2HCl═2NaCl+H2O+CO2↑),当稀盐酸滴加至36.5g时(烧杯内不再产生气体为止),烧杯内溶液的总质量为40.3g(产生的气体全部逸出).试计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com