
【题目】亚硒酸钠(Na2SeO3)可用于提升人体免疫力,硒元素在元素周期表中的部分信息及原子结构示意图如图1所示。下列说法正确的是( )
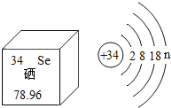
A. Se的元素化学性质表现为容易失电子
B. Se是一种金属元素
C. n的值为6
D. Se相对原子质量为78.96 g
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:
【题目】一碳化学是以分子中只含一个碳原子的化合物(如CO2、CH4等)为原料来合成一系列化工原料和燃料的化学。下图为利用合成气(CO和H2)合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程。下列有关说法不正确的是
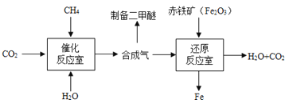
A. 催化反应室中发生的反应有利于减缓温室效应
B. 还原反应室中,所有元素的化合价都发生改变
C. 上述生产过程中,可参与循环的物质有水和二氧化碳
D. 由合成气制二甲醚的反应属于化合反应,符合绿色化学的特点
查看答案和解析>>
科目:初中化学 来源: 题型:
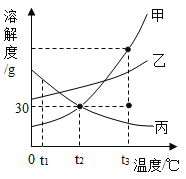
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )

A.要配置相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制t1℃
B.t2℃时,将30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5%
C.要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法
D.将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】称取氯化钠和氯化钡的固体混合物32.5克,加入82.8克蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的硫酸钠溶液,反应生成沉淀的质量与所加入的硫酸钠溶液的质量关系如图所示。试回答下列问题:
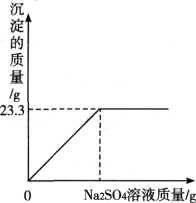
(1)完全反应后生成沉淀________克。
(2)恰好完全反应时消耗硫酸钠溶液的质量是多少克______?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为了研究在实验室中用某氯酸钾样品制取氧气的有关问题,他将5g氯酸钾样品与1g二氧化锰混合加热,在不同时刻测得部分数据如下表(友情提示:可把表中的空白补全后作答)。
加热时间 | t1 | t 2 | t3 | t4 |
剩余固体质量/g | 5.04 | 4.08 | ||
生成O2质量/g | 1.84 | 1.92 |
回答:
(1)t3时刻后,氯酸钾是否已经完全反应?_____。
(2)该样品中氯酸钾的质量分数_____。
(3)求t1时刻原氯酸钾中已分解的氯酸钾的质量分数____(写出解题过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,根据图中的信息回答下列问题:
(1)t2℃时,将50g丙放到100g水中,充分搅拌后所得溶液的溶质质量分数为_____(精确到1%);
(2)在不改变溶液溶质质量分数的前提下,若要将甲的饱和溶液转化为不饱和溶液可采用的方法是_____;
(3)t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温至t2℃,所得溶液中溶剂的质量由大到小的是_____。
(4)将等质量的甲、丙固体分别配成t2℃的饱和溶液,所需水的质量:甲_____丙(填“>”“<”或“=”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图所示是某化学反应的微观示意图,下列说法正确的是( )
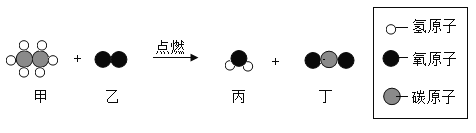
A. 该反应属于置换反应
B. 生成物丙由2个氢原子和1个氧原子构成
C. 生成物丁中碳和氧元素的质量比为1:2
D. 参加反应的甲和乙的分子个数比为2:7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
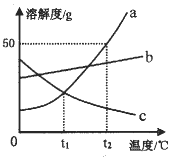
(1)温度为_______时,a、c两种物质的溶解度相同。
(2)将t2℃时a物质的饱和溶液30.0g稀释成10%的溶液,需加水___g;完成该实验需要的仪器是_____________。
(3)下列说法正确的是______。
A 将a物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小
B t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是a>b>c
C 配制一定溶质质量分数的b物质溶液,若量取水时俯视读数,其它操作均正确,则配制的b溶液中溶质的质量分数将偏高
D 若b物质中混有少量a物质,提纯b物质应该采用的方法是蒸发结晶
E 将t2℃时a、b、c三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是b>a>c
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自来水厂常用氯气杀菌消毒,用明矾、氯化铁等净化水。以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的流程如下图所示:
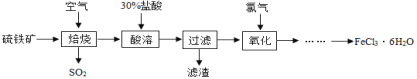
(1)“焙烧”前将硫铁矿进行粉碎,其目的是___。
(2)已知“焙烧”阶段就是硫铁矿的燃烧,生成物是Fe2O3和SO2,写出该反应的化学方程式__。
(3)大量排放出SO2能形成酸雨,危害环境。常用下列方法除去:
方法1:将含SO2的废气通入氨水中,以减少空气污染,反应的化学方程式为:2SO2+4NH3H2O+O2=2__+2H2O。某兴趣小组测定了不同溶质质量分数的氨水在不同温度下吸收SO2气体的情况,获得如下图象,从实验数据可知,吸收SO2最佳的生产条件是__、__;

方法2:将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫。写出该反应的化学方程式____。
(4)流程中用30%盐酸“酸溶”焙烧后的残渣,写出化学方程式____;若在实验室欲用质量分数为37%(密度为1.18 g/ml)的盐酸配制30%的100g盐酸,则需要加水___g(保留1位小数),需要的玻璃仪器有烧杯、___、___胶头滴管等。
(5)“氧化”后从FeCl3溶液中获得FeCl3·6H2O晶体的操作方法是:在HCl气流中蒸发浓缩、____、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com