
| A. | CoCl3读作“氯化亚钴” | |
| B. | CoCl3中钴元素的化合价为+2价 | |
| C. | 金属铜不能与CoCl2溶液发生反应 | |
| D. | CoCl2中钴元素的质量分数约为33.3% |
分析 A、根据化学式给物质命名;
B、根据化合物中正负化合价的代数和为0计算钴元素的化合价;
C、根据题意,金属钴(Co)与铁具有相似的化学性质,能够和盐酸反应,判断反应;
D、根据元素的质量分数公式计算.
解答 解:A、CoCl3读作“氯化钴”,故A说法错误;
B、CoCl3中氯元素的化合价为-1价,则钴元素的化合价为+3价,故B说法错误;
C、金属钴(Co)与铁具有相似的化学性质,能够和盐酸反应,说明Co位于氢前,因此Co的活动性比铜强,故铜不能和CoCl2溶液发生反应,故C说法正确;
D、CoCl2中钴元素的质量分数=$\frac{59}{59+35.5×2}$×100%≠33.3%,故D说法错误.
故选:C.
点评 本题属于信息题的考查,可以依据题目的信息结合相关的知识分析即可,难度不大.


科目:初中化学 来源: 题型:实验探究题
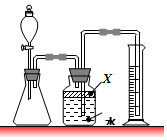 氮化铝(AlN)是一种新型无机材料.某氮化铝样品中含有碳或氧化铝杂质.已知氮化铝和NaOH溶液能反应,其反应方程式为:
氮化铝(AlN)是一种新型无机材料.某氮化铝样品中含有碳或氧化铝杂质.已知氮化铝和NaOH溶液能反应,其反应方程式为:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在空气中燃烧时,火星四射,有黑色物质生成 | |
| B. | 石蜡在氧气中燃烧时,有水和二氧化碳生成 | |
| C. | 红热木炭放入盛有氧气的集气瓶中,剧烈燃烧,产生白烟 | |
| D. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现浑浊现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
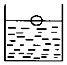 如图在室温下的饱和硝酸钾溶液中放了一个塑料小球.以下做法能使小球下沉的是( )
如图在室温下的饱和硝酸钾溶液中放了一个塑料小球.以下做法能使小球下沉的是( )| A. | 加入少量硝酸钾晶体,充分搅拌 | B. | 蒸发一些溶剂,恢复到室温 | ||
| C. | 升高温度,使硝酸钾晶体析出 | D. | 降低温度,使硝酸钾晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙、过滤 |
| B | KOH溶液 | KCl | 适量稀硫酸 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钡溶液、过滤 |
| D | H2 | CO | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 测定时刻 | 6:05 | 6:10 | 6:15 | 6:20 | 6:25 | 6:30 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com