
分析 根据稀盐酸的质量计算出Na2CO3的质量,进而求出混合物中NaCl的质量;第二小问反应后溶液中的溶质NaCl的包括混合物中自有的和反应生成的两部分,反应后溶液的总质量等于加进去的固体混合物的质量加上加进去的稀盐酸的质量减去生成的气体的质量,最后用反应后溶液中溶质的质量除以反应后溶液的质量即可;据此解答.
解答 解:(1)盐酸溶液中溶质的质量为:73g×10%=7.3g;
设碳酸钠的质量为x、生成的氯化钠的质量为y,生成的二氧化碳的质量为z.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x 7.3g y z
则$\frac{106}{x}=\frac{73}{7.3g}=\frac{117}{y}=\frac{44}{z}$,解得x=10.6g;y=11.7g;z=4.4g
原混合物中NaCl的质量为26.4g-10.6g=15.8g
(2)反应后溶液中NaCl的总质量为15.8g+11.7g=27.5g
反应后溶液的质量分数为=$\frac{27.5g}{26.4g+73g-4.4g}×100%$≈28.9%
故答案为:
(1)10.6g;(2)28.9%.
点评 计算反应后溶液的溶质质量分数时,要注意原混合物中的氯化钠因溶解也是反应后溶液中溶质的一部分.根据质量守恒定律,反应质量所得溶液质量=固体混合物的质量+所加入稀盐酸的质量-反应放出二氧化碳的质量.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编 号 | 第 1 次 | 第 2次 | 第 3次 |
| 所取固体样品的质量/g | 13 | 10 | 10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g | 100 | 100 | 125 |
| 反应后生成沉淀的质量/g | 8 | 8 | 8 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 用过氧化氢溶液和二氧化锰制氧气 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ 分解反应 | |
| B. | 用生石灰制熟石灰 CaO+H2O═Ca(OH)2 化合反应 | |
| C. | 用澄清石灰水鉴定CO2气体 CO2+Ca(OH)2═CaCO3↓+H2O 复分解反应 | |
| D. | 工业上用赤铁矿炼铁 3CO+Fe2O3$\frac{\underline{\;点燃\;}}{\;}$ 2Fe+3CO2 置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 质量/g | 102.0 | 101.0 | 100.5 | 100.2 | 100.1 | 100.4 | 100.1 | 100.1 | 100.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
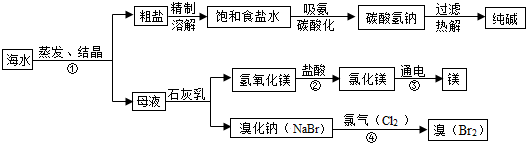
 在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:
在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
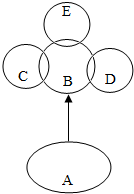 A、B、C、D、E分别是初中常见的五种物质,如图所示,“→”表示A可以在一定条件下生成B和一种无色无味的常见液体,且A通常情况下也为无色液体;C、D、E都能与B发生反应,且C与B反应的产物能使澄清的石灰水变浑浊,D能被磁铁所吸引,E为淡黄色粉末,回答问题:
A、B、C、D、E分别是初中常见的五种物质,如图所示,“→”表示A可以在一定条件下生成B和一种无色无味的常见液体,且A通常情况下也为无色液体;C、D、E都能与B发生反应,且C与B反应的产物能使澄清的石灰水变浑浊,D能被磁铁所吸引,E为淡黄色粉末,回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com