

分析 (1)根据天然气的形成、主要成分、燃烧的反应写出反应的方程式;
(2)根据活性炭的吸附性分析;
(3)根据使用乙醇,可以节约石油资源,减少空气污染等方面分析回答;
(4)①人类的呼吸作用需要氧气;
②常温下碳的化学性质稳定,不与其他物质发生化学反应;
③物质的性质决定物质的用途;
④根据空气中成分的体积含量考虑;根据物质的性质分析解答:二氧化碳是植物光合作用的原料,一氧化碳能与血红蛋白结合;
⑤铜用于制作导线是因为其具有良好的延展性和导电性;高炉炼铁的原理是在高温的条件下,一氧化碳把铁从铁矿石里还原出来;
⑥根据反应的微观示意图,分析反应的特点.判断反应的类型;根据反应的微观示意图及质量守恒定律分析反应生成物的分子个数比.
解答 解:(1)天然气属于不可再生能源,其主要成分是甲烷,在空气中充分燃烧生成了二氧化碳和水,反应的化学方程式为:CH4 +2O2$\frac{\underline{\;点燃\;}}{\;}$CO2 +2H2O.如果燃烧不充分会产生CO气体,污染空气.
(2)由于活性炭有吸附性,可以吸附有毒的气体;
(3)乙醇燃烧能放出大量的热,又因为它是用粮食经发酵酿制成的,因此它是可再生能源,在汽油中加入乙醇,能节约石油资源,而且排出的有害气体也少,有利于保护环境.
(4)①人类的呼吸作用需要氧气,医疗上急救时需要氧气是因为氧气能供给呼吸,故答案为:供给呼吸;
②墨的主要成分是碳,用墨书写或绘制的字画能够保存很长时间不变色,是因为常温下碳的化学性质稳定,故答案为:常温下碳的化学性质稳定;
③二氧化碳能用于灭火,根据灭火的原理分析可知,二氧化碳不能燃烧,也不能支持燃烧;二氧化碳密度比空气大,还可以起到隔绝氧气的作用,达到灭火的目的,故答案为:不燃烧不支持燃烧;密度比空气大;
④空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.所以氮气最多;光合作用的原料有二氧化碳和水,所给方程式中只能是二氧化碳;一氧化碳能与血红蛋白结合,使人体缺氧而中毒;具有吸附作用的物质有活性炭;
⑤铜用于制作导线是因为其具有良好的延展性和导电性;高炉炼铁的原理是在高温的条件下,一氧化碳把铁从铁矿石里还原出来,化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
⑥目前人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和天然气;由反应的微观示意图可知,该反应由一种单质和化合物反应,生成了另一种单质和另一种化合物,属于置换反应.
由反应的微观示意图及质量守恒定律可知,该图示中一个碳原子与一个水分子反应,生成了一个易氧化碳分子和一个氢分子,所以,该反应生成物的分子个数比为1:1.
故答为:(1)不可再生,CH4 +2O2$\frac{\underline{\;点燃\;}}{\;}$CO2 +2H2O;CO;
(2)吸附;
(3)节省石油资源,减少汽车尾气的污染;
(4)①供给呼吸;②常温下碳的化学性质稳定;③不燃烧不支持燃烧;密度比空气大;④)N2;CO2;CO;⑤导电;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
⑥天然气;置换;1:1.
点评 化石燃料是当代的主要能源,化石燃料的燃烧会产生大量的空气污染物,而且储量有限,人们正在寻找替代能源,与之相关问题成为考查的重点内容.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | Ca(H2PO4)2 | C. | K2CO3 | D. | CO(NH2)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
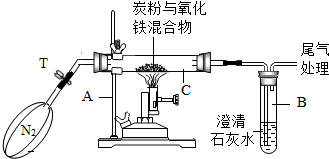 某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 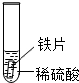 | 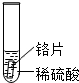 | 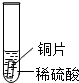 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
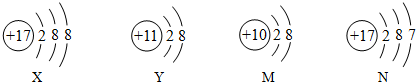
| A. | 以上四种粒子分别属于三种元素 | |
| B. | 粒子Y若得到1个电子就可以变成原子 | |
| C. | 如果X和Y能形成稳定的化合物,则化学式应为XY | |
| D. | 上述粒子中有两个是离子,两个是原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
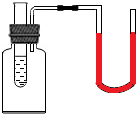 如图所示,集气瓶瓶塞中插有小试管和导管,小试管中盛有少量水,导管连接的U型管两侧内水面持平.向试管中加入下列物质中的一种,U型管两侧水面出现左低右高,则加入的物质为①CaO②NaOH③NaCl④硝酸铵⑤浓H2SO4( )
如图所示,集气瓶瓶塞中插有小试管和导管,小试管中盛有少量水,导管连接的U型管两侧内水面持平.向试管中加入下列物质中的一种,U型管两侧水面出现左低右高,则加入的物质为①CaO②NaOH③NaCl④硝酸铵⑤浓H2SO4( )| A. | ②或③或⑤ | B. | ①或③或⑤ | C. | ①或②或④ | D. | ①或②或⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com