
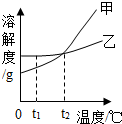
 分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NaCl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度表中的数据可知,氯化钠的溶解度受温度影响较小,所以氯化钠的溶解度曲线是乙:
(2)20℃时,氯化铵的溶解度是37.2g,所以将40gNH4Cl加入100g的水中,充分搅拌后得到的是饱和溶液,将上述溶液升温到30℃,固体全部溶解,所以该溶液的溶质质量分数为:$\frac{40g}{100g+40g}$×100%;
(3)t1℃时,乙物质的溶解度大于甲物质的溶解度,所以将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是乙;
(4)计算配制50g质量分数为3%的NaCl溶液,所需要质量分数为6%的NaCl溶液的体积,依据溶液稀释前后可以计算6%的氯化钠溶液的质量,需要知道6%的NaCl溶液的密度,才能计算体积,故选:C.
故答案为:(1)乙;
(2)饱和,$\frac{40g}{40g+100g}$×100%;
(3)乙;
(4)C.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧,生成刺激性气味的气体 | |
| B. | 加热硫酸铜晶体,固体会由蓝色变白色 | |
| C. | 红磷在空气中燃烧产生大量白雾 | |
| D. | 铁丝在空气中燃烧,火星四射,生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 5 | 2 | 20 | 22 |
| 反应后质量/g | 待测 | 11 | 28 | 5 |
| A. | 反应后甲的质量是0g | B. | 甲可能是该反应的催化剂 | ||
| C. | 乙、丙变化的质量比为9:8 | D. | 该反应是分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com