
| A. | 黄铜 | B. | 青铜 | C. | 生铁 | D. | 四氧化三铁 |
科目:初中化学 来源: 题型:解答题
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀盐酸体积/mL | 40 | 40 | 40 | 40 | 40 |
| 剩余固体的质量/g | 103 | 73 | 36 | 33 | 25 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 人被蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,为减轻痛痒可以在皮肤上涂一些浓氯化钠溶液 | |
| B. | 香烟烟气中的CO会使血红蛋白携氧能力降低 | |
| C. | 稀盐酸、稀硫酸都可用于金属表面除锈 | |
| D. | 自行车的车架表面喷涂油漆可以防止生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 探究“酸和碱之间中和反应”,在烧杯中加入约5mL稀氢氧化钠溶液,滴入几洋酚酞溶液,用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止,小马虎在探究实验中,将一滴管稀盐酸瞬间一次性滴入烧杯中,他发现溶液立即由红色变成无色,于是他得出“酸和碱恰好完全中和”的结论.
探究“酸和碱之间中和反应”,在烧杯中加入约5mL稀氢氧化钠溶液,滴入几洋酚酞溶液,用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止,小马虎在探究实验中,将一滴管稀盐酸瞬间一次性滴入烧杯中,他发现溶液立即由红色变成无色,于是他得出“酸和碱恰好完全中和”的结论.| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠能与油脂发生反应,可用作厕所清洁剂 | |
| B. | 氢氧化钙能与二氧化碳反应,可用于粉刷墙壁 | |
| C. | 碳具有还原性,可用于冶金工业 | |
| D. | 活性炭有吸附性,可以除去冰箱中的异味 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
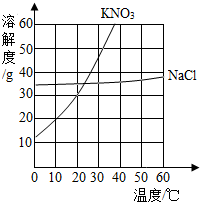 如图为硝酸钾和氯化钠的溶解度曲线.由图可知:
如图为硝酸钾和氯化钠的溶解度曲线.由图可知:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
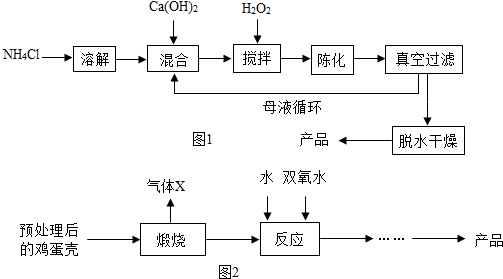
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com