
| 选项 | 化学规律 | 示例 |
| A | 物质结构决定性质 | 由于碳原子排列方式不同,金刚石与石墨物理性质存在很大差异 |
| B | 现象说明微观本质 | 物体热胀冷缩现象,说明构成物质的微粒间距离发生了变化 |
| C | 性质决定物质用途 | 甲醛能使蛋白质变性,可用甲醛溶液浸泡海鲜食品来保鲜 |
| D | 性质决定鉴别方法 | 有些物质燃烧气味不同,可用灼烧闻气味区分羊毛绒和棉线 |
| A. | A | B. | B | C. | C | D. | D |
科目:初中化学 来源: 题型:解答题
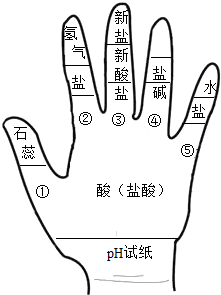 化学与生活、生产息息相关,请用所学化学知识回答.
化学与生活、生产息息相关,请用所学化学知识回答.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
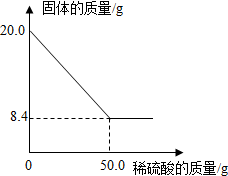 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 带火星的木条 | B. | 铁丝燃烧 | C. | 燃着的木条 | D. | 红磷燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
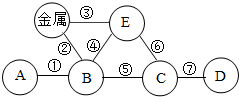 构建知识网络是化学学习中的常用方法.下图是某同学在复习“我们身边的化学物质”时构建的知识网络,其中A、B、C、D、E分别表示非金属氧化物、金属氧化物、酸、碱、盐中的某一种,“-”表示物质之间普遍能够发生的化学反应.
构建知识网络是化学学习中的常用方法.下图是某同学在复习“我们身边的化学物质”时构建的知识网络,其中A、B、C、D、E分别表示非金属氧化物、金属氧化物、酸、碱、盐中的某一种,“-”表示物质之间普遍能够发生的化学反应.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
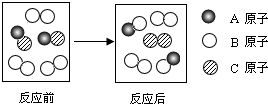
| A. | 该反应前后分子的种类和数目一定改变 | |
| B. | 该反应的生成物都属于氧化物 | |
| C. | 参加反应的A、B、C各原子的个数比为1:2:2 | |
| D. | 该反应的基本类型为置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
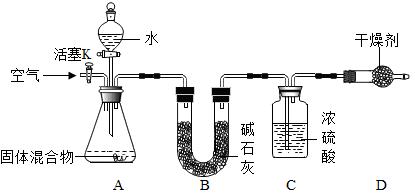
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com