
”¾ĢāÄæ”æĻņŅ»¶ØĮæµÄĀČ»ÆĶČÜŅŗÖŠ¼ÓČė¹żĮæµÄĢś·Ū£¬¼ÓČėĢś·ŪµÄÖŹĮæŗĶĖłµĆ¹ĢĢåÖŹĮæ¹ŲĻµČēĶ¼1ĖłŹ¾”£¹żĀĖPµćŹ±µÄ»ģŗĻĪļ£¬ĻņĀĖŅŗÖŠ²»¶Ļ¼ÓČėĻõĖįŅųČÜŅŗ£¬¼ÓČėµÄČÜŅŗÖŹĮæÓėÉś³É³ĮµķÖŹĮæČēĶ¼2ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
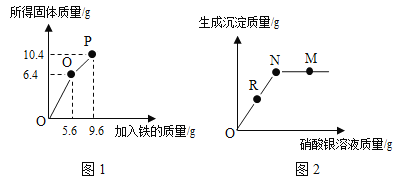
A. NµćŹ±£¬ĖłµĆ³ĮµķÖŹĮæĪŖ14.35g
B. MµćŹ±£¬ÉĻ²ćČÜŅŗÖŠČÜÖŹÓŠĮ½ÖÖ
C. OµćŗĶPµćĖłµĆČÜŅŗÖŠČÜÖŹÖÖĄąĻąĶ¬
D. Rµ½Mµć¹ż³ĢÖŠ£¬ĖłµĆČÜŅŗµÄÖŹĮæ²»¶ĻŌö“ó
”¾“š°ø”æA
”¾½āĪö”æ
ĻņŅ»¶ØĮæµÄĀČ»ÆĶČÜŅŗÖŠ¼ÓČė¹żĮæµÄĢś·Ū£¬¼ÓČėĢś·ŪµÄÖŹĮæŗĶĖłµĆ¹ĢĢå·¢ÉśµÄ·“Ó¦·½³ĢŹ½£ŗCuCl2+Fe=Cu+FeCl2”£¹żĀĖPµćŹ±µÄ»ģŗĻĪļ£¬ĻņĀĖŅŗÖŠ²»¶Ļ¼ÓČėĻõĖįŅųČÜŅŗ£¬FeCl2+2AgNO3=Fe(NO3)2+2AgCl”ż”£ÓÉĶ¼1æÉÖŖ£¬OµćŹ±£¬ĶĄė×Ó·“Ó¦ĶźČ«£¬Ģś²ĪÓė·“Ó¦µÄÖŹĮæĪŖ5.6g”£
A”¢ÉčĀĖŅŗÖŠµÄŗ¬FeCl2ĪŖx£¬
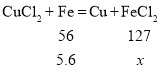 £¬Ōņ
£¬Ōņ![]() £¬æɵĆx=12.7g£¬
£¬æɵĆx=12.7g£¬
ŌņÉčÉś³ÉĀČ»ÆŅų³ĮµķĪŖy£¬
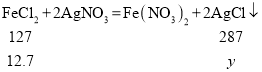 £¬Ōņ
£¬Ōņ![]() £¬æɵĆy=28.7g£¬Ń”ĻīA²»ÕżČ·£»
£¬æɵĆy=28.7g£¬Ń”ĻīA²»ÕżČ·£»
B”¢MµćŹ±£¬ĀČĄė×Ó·“Ó¦Ķź³É£¬ŌņÉĻ²ćČÜŅŗÖŠÖ»ÓŠČÜÖŹAgNO3ŗĶFe(NO3)2£¬Ń”ĻīBÕżČ·£»
C”¢OµćŹ±ĶĄė×Ó·“Ó¦Ķź³É£¬“ĖŹ±ČÜŅŗµÄČÜÖŹĪŖFeCl2£»PµćŹ±£¬ČÜŅŗµÄČÜÖŹĪŖFeCl2£¬Ń”ĻīCÕżČ·£»
D”¢Rµ½Mµć¹ż³ĢÖŠ£¬¼ÓČėµÄĻõĖįŅųÖŹĮæ“óÓŚ³ĮµķĀČ»ÆŅųÖŹĮ棬¹ŹĖłµĆČÜŅŗµÄÖŹĮæ²»¶ĻŌö“ó£¬Ń”ĻīDÕżČ·£»
¹ŹŃ”A”£


 ³É¹¦ŃµĮ·¼Ę»®ĻµĮŠ“š°ø
³É¹¦ŃµĮ·¼Ę»®ĻµĮŠ“š°ø ±¶ĖŁŃµĮ··ØÖ±ĶØÖŠæ¼æ¼µćĻµĮŠ“š°ø
±¶ĖŁŃµĮ··ØÖ±ĶØÖŠæ¼æ¼µćĻµĮŠ“š°ø Ņ»¾ķøć¶ØĻµĮŠ“š°ø
Ņ»¾ķøć¶ØĻµĮŠ“š°ø ĆūŠ£×÷Ņµ±¾ĻµĮŠ“š°ø
ĆūŠ£×÷Ņµ±¾ĻµĮŠ“š°ø ĒįĒɶį¹ŚÖܲāŌĀæ¼Ö±ĶØĆūŠ£ĻµĮŠ“š°ø
ĒįĒɶį¹ŚÖܲāŌĀæ¼Ö±ĶØĆūŠ£ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĶ¼Ļó²»ÄÜÕżČ··“Ó³Ęä¶ŌÓ¦¹ŲĻµµÄŹĒ£Ø””””£©
A. 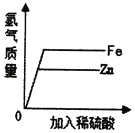 ĻņµČÖŹĮæµÄĢś”¢ŠæÖŠ·Ö±š¼ÓČėĻ”ĮņĖį
ĻņµČÖŹĮæµÄĢś”¢ŠæÖŠ·Ö±š¼ÓČėĻ”ĮņĖį
B. 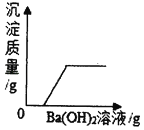 ĻņH2SO4ŗĶMgCl2µÄ»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓBa£ØOH£©2ČÜŅŗÖĮ¹żĮæ
ĻņH2SO4ŗĶMgCl2µÄ»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓBa£ØOH£©2ČÜŅŗÖĮ¹żĮæ
C. 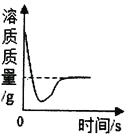 ijĪĀ¶ČŹ±£¬ĻņŅ»¶ØĮæµÄ±„ŗĶŹÆ»ŅĖ®ÖŠ¼ÓČėÉŁĮæÉśŹÆ»Ņ
ijĪĀ¶ČŹ±£¬ĻņŅ»¶ØĮæµÄ±„ŗĶŹÆ»ŅĖ®ÖŠ¼ÓČėÉŁĮæÉśŹÆ»Ņ
D. 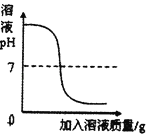 ĻņŅ»¶ØĮæµÄĒāŃõ»ÆÄĘČÜŅŗÖŠµĪ¼ÓĻ”ĮņĖį
ĻņŅ»¶ØĮæµÄĒāŃõ»ÆÄĘČÜŅŗÖŠµĪ¼ÓĻ”ĮņĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ£Éē»į“óæĪĢĆ»ī¶Æ×éÖÆĶ¬Ń§ĆĒ×ß½ųĮĖĪŪĖ®“¦Ąķ³§”£

£Ø1£©²Ī¹ŪĪŪĖ®µÄµŚŅ»µĄ“¦Ąķ¹¤ŠņŹ±£¬ĻÖ³”ĆÖĀž×ÅÄŃĪŵÄĘųĪ¶,Ķ¬Ń§ĆĒ²»½ūŃŚ×”æŚ±Ē”£“ÓĪ¢Į£µÄ½Ē¶ČĖµĆ÷ÄÜĪŵ½ĘųĪ¶µÄŌŅņŹĒ________”£
£Ø2£©ĪŪĖ®µÄµŚŅ»µĄ“¦Ąķ¹¤ŠņŹĒ¾¹żøńÕ¤£¬øńÕ¤ŹĒ“ųÓŠ¹ęŌņ·Ö²¼µÄ·½ŠĪĶųøń£¬Ęä×÷ÓĆŹĒ_______”£
£Ø3£©¶ž“Ī³Įµķ³ŲµÄÖ÷ŅŖ×÷ÓĆŹĒ·ÖĄė³ö»īŠŌĪŪÄą”£»īŠŌĪŪÄąµÄ×÷ÓĆŹĒĄūÓĆĪ¢ÉśĪļ½«ĪŪĖ®ÖŠµÄŅ»Š©ÓŠŗ¦ĪļÖŹŌŚŃõĘųµÄ×÷ÓĆĻĀ¾¹żÉśĪļ½µ½ā×Ŗ»ÆĪŖÕÓĘų”£ÕÓĘų£ØÖ÷ŅŖ³É·ÖĪŖ¼×Ķ飩æÉ×÷ĪŖÄÜŌ“Ź¹ÓĆ”£ÕÓĘųČ¼ÉյĻÆѧ·“Ó¦·½³ĢŹ½ĪŖ____”£
£Ø4£©Ä³¹¤³§ŌŚÅÅ·Åŗ¬ĮņĖįµÄĖįŠŌ·ĻĖ®Ź±ÓĆĒāŃõ»ÆÄĘ½ųŠŠ“¦Ąķ£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ę·ÅĘ“æ¼īÖŠŗ¬ÓŠŌÓÖŹNaCl£¬»ÆѧŠĖȤŠ”×éµÄĶ¬Ń§½ųŠŠĮĖČēĻĀŹµŃéĢ½¾æ£ŗ³ĘČ”12gѳʷ·ÅČėÉÕ±ÖŠ£¬¼ÓČėĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųÅŻĪŖÖ¹£¬²¢»ęÖĘ³ö¼ÓČėĻ”ŃĪĖįµÄÖŹĮæÓė·Å³öĘųĢåÖŹĮæµÄ¹ŲĻµČēĶ¼
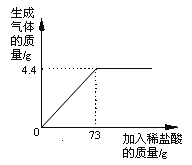
£Ø1£©“æ¼īĒ”ŗĆĶźČ«·“Ó¦Ź±£¬Éś³ÉCO2µÄÖŹĮæĪŖ g
£Ø2£©¼ĘĖćøĆѳʷ֊ŗ¬ŌÓÖŹµÄÖŹĮæ·ÖŹżŹĒ¶ąÉŁ£æ£Ø¼ĘĖć½į¹ū±£ĮōŅ»Ī»Š”Źż£¬ĻĀĶ¬£©
£Ø3£©¼ĘĖćµ±ŃĪĖįÓė“æ¼īĒ”ŗĆĶźČ«·“Ó¦Ź±£¬ĖłµĆČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżŹĒ¶ąÉŁ£æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČĖĢåȱ·¦Ī¬ÉśĖŲC£Ø¼ņ³ĘVc£©æÉÄÜ»¼»µŃŖ²”£¬ČēĶ¼ĪŖijÖÖ”°Ī¬ÉśĖŲC”±ĖµĆ÷ŹéµÄŅ»²æ·Ö£¬Ēė»Ų“š£ŗ

£Ø1£©”°Vc”±ŹōÓŚ_____£ØĢī”°ÓŠ»ś”±”°ĪŽ»ś”±£©»ÆŗĻĪļ”£
£Ø2£©”°Vc”±ÖŠĢ¼ĒāŃõŌ×ÓµÄøöŹż±ČŹĒ_____”£
£Ø3£©”°Vc”±ÖŠŗ¬Įæ×īøߵďĒ_____ŌŖĖŲ”£
£Ø4£©ČōÕż³£³ÉÄźČĖĆæĢģ×īµĶŠčŅŖ²¹³ä”°Vc”±60mgŹ±£¬ÕāŠ©”°Vc”±ĶźČ«ÓÉĶ¼ÖŠ”°Ī¬ÉśĖŲC”±Ą“²¹³äŹ±£¬ŌņĆæ“ĪÖĮÉŁ·žÓĆ_____ʬ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĖ®¹øÓÉCaCO3”¢Mg(OH)2”¢MgCO3ČżÖÖĪļÖŹ×é³É£¬ĪŖĢ½¾æĘäÖŠø÷øö³É·ÖµÄÖŹĮæ·ÖŹż£¬ĻÖ½ųŠŠČēĻĀĶ¼ĖłŹ¾µÄŹµŃ锣ŅŃÖŖ£ŗø÷ŹŌ¼Į¾ł×ćĮ棬CaCO3”¢Mg(OH)2”¢MgCO3ČżÖŠĪļÖŹŌŚŅ»¶ØµÄĪĀ¶ČĻĀ¶¼»į·Ö½ā³ÉĮ½ÖÖŃõ»ÆĪļ”£
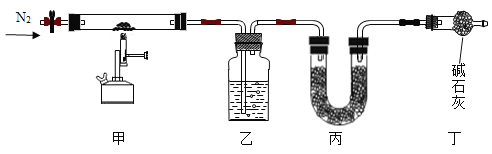
ŹµŃé²½ÖčČēĻĀ£ŗ
I.¼ģ²é×°ÖƵÄĘųĆÜŠŌ£¬³ĘČ”40gµÄĖ®¹ø·ÅČė¼××°ÖĆ£¬ĶØČėN2£¬Č»ŗóĮ¬½Ó¼×”¢ŅŅ”¢±ū”¢¶”£»
II.µćČ¼¾Ę¾«ÅēµĘ£¬ÖĮ²»ŌŁ·“Ó¦ŗóĻØĆš¾Ę¾«ÅēµĘ£¬¼ĢŠųĶØČėN2Ņ»¶ĪŹ±¼ä£¬²āµĆŅŅ”¢±ū×°ÖĆÖŹĮæ·Ö±šŌö¼Ó3.6gŗĶ13.2g”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öCaCO3·Ö½āµÄ»Æѧ·½³ĢŹ½________________”£
£Ø2£©ŅŅÖŠµÄŹŌ¼ĮĪŖ______________£¬±ū×°ÖƵÄ×÷ÓĆŹĒ___________”£
£Ø3£©²½ÖčŅ»ÖŠĶØČėµŖĘųµÄÄæµÄŹĒ_________________”£
£Ø4£©øĆĖ®¹øÖŠMg(OH)2µÄÖŹĮæ·ÖŹżĪŖ___________”£
£Ø5£©¹ŲÓŚøĆŹµŃ飬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________
A ·“Ó¦½įŹųŗ󣬼×ÖŠ¹ĢĢå³É·ÖĪŖĮ½ÖÖ
B Čōƻӊ¶”×°ÖĆ£¬»įµ¼ÖĀ²āµĆµÄCaCO3ÖŹĮæĘ«“ó
C øł¾ŻŹµŃ鏿¾Ż½ųŠŠ¼ĘĖć£¬MgCO3µÄÖŹĮæ·ÖŹżĪŖ21%
D Čō²½Ö趞ŗó£¬Ć»ÓŠ¼ĢŠųĶØČėN2£¬»įµ¼ÖĀ²āµĆµÄMg(OH)2ÖŹĮæĘ«Š”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫5%µÄNaOHČÜŅŗÖšµĪ¼ÓČėµ½10gĻ”ŃĪĖįÖŠ£¬±ß¼Ó±ß½Į°č£¬Ėę×ÅNaOHČÜŅŗµÄ¼ÓČė£¬ČÜŅŗpHµÄ±ä»ÆČēĶ¼ĖłŹ¾£®±ß»Ų“š£ŗ
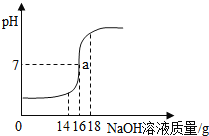
£Ø1£©aµćČÜŅŗÖŠ“óĮæ“ęŌŚµÄĄė×ÓÓŠ_____£»
£Ø2£©¼ĘĖćĻ”ŃĪĖįÖŠČÜÖŹµÄÖŹĮæ·ÖŹż_____
£Ø3£©µ±Ē”ŗĆĶźČ«·“Ó¦Ź±£¬ĖłµĆČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹż£æ_____
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŹµŃ銔×éµÄĶ¬Ń§ĄūÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃé:
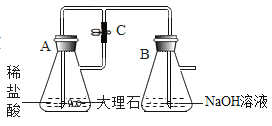
(1)AÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______________
(2)AÖŠ·“Ó¦æŖŹ¼Ź±£¬µÆ»É¼ŠC“¦ÓŚ“ņæŖדĢ¬£¬B ÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________________
(3)Ņ»¶ĪŹ±¼äŗó,¹Ų±Õ C,×°ÖĆ A ÖŠČŌŌŚ·“Ó¦”£¹żŅ»»į¶ł£¬¹Ū²ģµ½×°ÖĆ BÖŠ³öĻÖ°×É«³Įµķ,øĆ³ĮµķµÄ»ÆѧŹ½ĪŖ________________”£
(4)Š”×éĶ¬Ń§Ģ½¾æ·“Ó¦ŗó×°ÖĆ B ÖŠµÄČÜŅŗµÄČÜÖŹ³É·Ö”£
£ØĢį³öĪŹĢā£©·“Ó¦ŗó×°ÖĆ B ÖŠČÜŅŗµÄČÜÖŹ³É·ÖŹĒŹ²Ć“?
£Ø²ĀĻėÓė¼ŁÉč£©²ĀĻė 1:NaCl”¢HCl ²ĀĻė 2: NaCl”¢CaCl2
²ĀĻė 3:NaCl”¢NaOH ²ĀĻė 4:NaCl”¢NaOH”¢Na2CO3
£Ø½»Į÷ĢÖĀŪ£©¾ĢÖĀŪ£¬“ó¼ŅŅ»ÖĀČĻĪŖ²ĀĻė_______________Ņ»¶Ø²»ŗĻĄķ£¬ĄķÓÉŹĒ ______________”£
£ØŹµŃéĢ½¾æ£©½«·“Ó¦ŗó×°ÖĆ B ÖŠĖłµĆ»ģŗĻĪļ¹żĀĖȔɣĮæĀĖŅŗ·Ö±š½ųŠŠČēĻĀŹµŃé: ŹµŃé 1:ĻņĀĖŅŗÖŠµĪ¼ÓĢ¼ĖįÄĘČÜŅŗĪŽĆ÷ĻŌĻÖĻó£¬Ōņ²ĀĻė_______________²»ÕżČ·”£
ŹµŃé 2:Ēėøł¾Ż±ķÖŠÄŚČŻĢīŠ“£»
ŹµŃéĢį¹©µÄŅ©Ę·ÓŠ:·ÓĢŖČÜŅŗ”¢Ļ”ŃĪĖį”¢Ba£ØOH)2,ČÜŅŗ BaC12 ČÜŅŗ”£
ŹµŃé²Ł×÷ | ĻČĻņĀĖŅŗÖŠ¼ÓČė¹żĮæ_______________ | ŌŁĻņĀĖŅŗÖŠµĪ¼Ó·ÓĢŖČÜŅŗ |
ŹµŃéĻÖĻó | _______________ | ______________ |
ŹµŃé½įĀŪ | ²ĀĻė 4 ÕżČ· | |
£Ø·“Ė¼ĘĄ¼Ū£©ŹµŃé½įŹųŗó£¬Ķ¬Ń§ĆĒ¾¹ż½»Į÷ÓėĢÖĀŪŗóČĻĪŖ:Ģ½¾æ·“Ó¦ŗóĖłµĆČÜŅŗµÄČÜÖŹ³É·ÖŹ±,²»½öŅŖæ¼ĀĒÉś³ÉĪļ,»¹ŅŖæ¼ĀĒ·“Ó¦ĪļŹĒ·ń¹żĮ攣
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·Ļ¾ÉµēĀ·°åÖŠÖ÷ŅŖŗ¬ÓŠĖÜĮĻ”¢ĶŗĶĪż£ØSn£©µČ£¬ĪŖŹµĻÖ¶ŌĘäÖŠĪżµÄĀĢÉ«»ŲŹÕ£¬Ä³¹¤ŅÕĮ÷³ĢČēĶ¼£ŗ
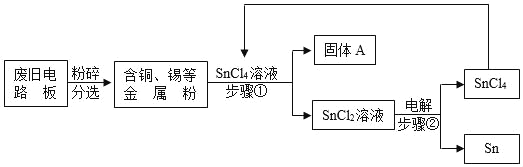
ŅŃÖŖ£ŗSn+SnCl4ØT2SnCl2
£Ø1£©SnCl4ÖŠČōĀČŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ©1¼Ū£¬ŌņĪżĄė×ÓæɱķŹ¾ĪŖ_____”£
£Ø2£©ĶµÄ½šŹō»ī¶ÆŠŌ±ČĪżµÄ_____£ØĢī”°Ēæ”±»ņ”°Čõ”±£©£¬¹ĢĢåAÖŠŅ»¶Øŗ¬ÓŠµÄ½šŹōŌŖĖŲŹĒ_____”£
£Ø3£©Š“³ö²½Öč¢Ś·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½_____£»
£Ø4£©Ļą±ČÓŚÖ±½Ó·ŁÉÕ·Ļ¾ÉµēĀ·°å»ŲŹÕ½šŹō£¬øĆ¹¤ŅÕµÄÖ÷ŅŖÓŵćŹĒ_____£Ø»Ų“šŅ»µć¼“æÉ£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com