
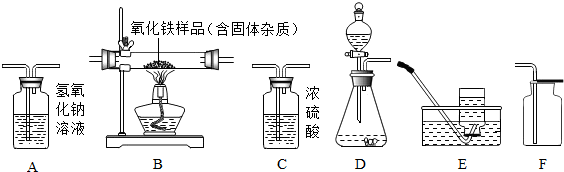
分析 (1)根据实验室制备氧气的实验步骤、原理以及注意事项进行解答;
(2)A2处放的是氢氧化钠溶液,可与一氧化碳和氧化铁反应生成的二氧化碳充分反应,故该装置增加的质量即是反应生成的二氧化碳的质量,然后结合一氧化碳和氧化铁反应的方程式计算出参加反应的氧化铁的质量,据氧化铁的质量分数计算即可;若上述连接仪器没有使用A1装置,则A2装置增重的质量既包括反应生成的二氧化碳,还包括本来就有的二氧化碳,会使计算的氧化铁的质量增加,纯度比实际值偏大.
解答 解:(1)①由过氧化氢溶液和二氧化锰为原料在实验室中制备并收集干燥的氧气实验步骤可知:所选仪器的连接顺序为A→D→F;
②所发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③用排空气法收集气体时,检验集气瓶内收集满氧气的方法是拿一根带火星的木条放在集气瓶口,若木条复燃,则证明集气瓶内已充满氧气;
(2))①欲用一氧化碳气体(含少量二氧化碳气体)测定某不纯氧化铁样品的纯度(杂质不参与任何反应),并验证反应中气体生成物的性质,则须先除去二氧化碳,避免干扰,除去二氧化碳用氢氧化钠溶液;
A2处放的是氢氧化钠溶液,可与一氧化碳和氧化铁反应生成的二氧化碳充分反应,故该装置增加的质量即是反应生成的二氧化碳的质量;
设样品中氧化铁的质量为x
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
x ng
$\frac{160}{x}=\frac{132}{ng}$
x=$\frac{40n}{33}$g
该氧化铁样品中含Fe2O3的质量分数是$\frac{\frac{40n}{33}g}{Wg}×$100%=$\frac{40n}{33W}$×100%;
③若上述连接仪器没有使用A1装置,则A2装置增重的质量既包括反应生成的二氧化碳,还包括本来就有的二氧化碳,会使计算的氧化铁的质量增加,纯度比实际值偏大;
④对于该实验方案设计还存在不完善之处,具体改进方案是装置末端加一只燃着的酒精灯,处理尾气.
答案:
(1)①D→C→F;
②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③拿一根带火星的木条放在集气瓶口,若木条复燃,则证明集气瓶内已充满氧气.
(2)①吸收水分(或干燥一氧化碳气体);
②$\frac{40n}{33W}$×100%;
③偏大;
④装置末端加一只燃着的酒精灯,处理尾气.
点评 本题综合考查了常见的气体制备、干燥、净化和收集实验,一氧化碳还原氧化铁的化学反应以及相关知识的考查,要结合所学知识细心解答.


科目:初中化学 来源: 题型:实验探究题
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品的质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 加稀硫酸的质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 剩余物的质量(g) | 89.6 | 129.2 | 169 | 209 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 工业上常用稀硫酸除去铁锈,是因为稀硫酸能与三氧化二铁反应 | |
| B. | 洗涤剂常用来去除油污,是因为洗涤剂具有乳化作用 | |
| C. | 氢氧化钙可用来改良酸性土壤,是因为氢氧化钙溶液呈碱性 | |
| D. | 液氧可用于火箭发射,是因为液氧具有可燃性 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 预期现象 | 结论 |
| 步骤1:取少量原固体样品于试管中,逐渐加水并不断搅拌至烧杯内固体不再溶解 | 有白色固体 | 假设1成立. |
| 步骤2:向步骤1反应后的白色固体中滴加足量稀稀HNO3溶液,并不断震荡 | 白色固体完全溶解,有气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 能使紫色石蕊溶液变红色 | B. | 能与氢氧化钠反应生成水 | ||
| C. | 能与铝粉反应生成氢气 | D. | 能与二氧化碳反应生成水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com