将一块质量为7.5克表面蒙有氧化物的锌片,放入浓度为30%的稀硫酸中,充分反应后得到的气体恰好与7.95克的一种不溶于水的黑色粉末完全反应,得到一种不与盐酸反应的红色金属,求此锌片的纯度.
【答案】
分析:因为铜是红色金属,不能与盐酸反应.氧化铜是黑色粉末,锌与硫酸反应产生氢气,可以还原出氧化铜中的铜.故可推断,第二个反应为氢气还原氧化铜的反应.因为反应中锌片和氧化铜都完全反应,而且都与生成氢气的质量成正比,所以可以直接利用氧化铜和锌的质量成比例的关系,求出锌的质量,再根据质量分数公式计算即可.
解答:解:设与稀硫酸反应的锌的质量为X,
Zn+H
2SO
4=ZnSO
4+H
2↑
CuO+H
2=Cu+H
2O
∴CuO-Zn
80 65
7.95g,X
∴
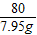
=
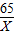
,
解之得:X=6.46g;
锌片纯度为:
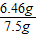
×100%=86.1%.
答:此锌片的纯度为86.1%.
点评:本题主要考查学生利用化学方程式和质量分数公式进行计算的能力.要求学生能根据题意和生活经验推断出化学方程式,然后根据化学方程式进行计算.

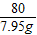 =
=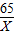 ,
,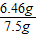 ×100%=86.1%.
×100%=86.1%.
