
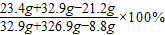 =10%
=10%

科目:初中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验步骤及操作方法 | 实验现象 | 结 论 |
| a、向装有滤液的烧杯中滴加 硝酸银溶液 |
有白色沉淀产生 有白色沉淀产生 |
假设③成立 |
| b、过滤后,向白色沉淀中加入足量的 稀硝酸 稀硝酸 . |
白色沉淀部分溶解,且有 气泡 气泡 产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象和结论 |
| 步骤1: 取少量的澄清滤液于试管中,然后向其中加入足量的硝酸钡溶液, 取少量的澄清滤液于试管中,然后向其中加入足量的硝酸钡溶液, |
①若产生白色沉淀,则含有碳酸钾; ②若无明显现象,则猜想④不正确; ①若产生白色沉淀,则含有碳酸钾; ②若无明显现象,则猜想④不正确; |
| 步骤2: 将步骤1中的溶液静置,然后取上层清液于试管中,然后向其中滴加酚酞试液 将步骤1中的溶液静置,然后取上层清液于试管中,然后向其中滴加酚酞试液 |
①若溶液变为红色,则含有氢氧化钾; ②若溶液不变色说明猜想④不正确; ①若溶液变为红色,则含有氢氧化钾; ②若溶液不变色说明猜想④不正确; |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com