
课外探究小组对实验教师提供的一包白色固体(可能是NaCl、Na2SO4、Na2CO3和NaNO3的一种或几种)进行了下面的实验,且每步实验中均加入足量的试剂,至充分反应。实验过程、现象见下图:
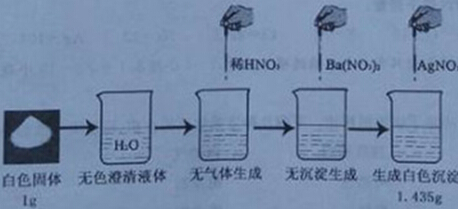
请分析实验过程并完成以下问题:
(1)实验中不能用稀盐酸代替稀硝酸的原因是 ;
(2)滴加Ba(NO3)2的目的是 ;
(3)通过计算推断:原白色固体的成分为 。(简单写出必要的计算过程)。
【答案】(1)防止稀盐酸与AgNO3溶液反应,对判断是否含有NaCl造成干扰;(2)检验白色固体中是否含有Na2SO4;(3)NaCl:0.585g 、NaNO3:0.415g。
解:原白色固体中氯化钠的质量为x。
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 1.435g,列比例式: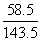 =
=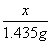 ,解得:x=0.585g。
,解得:x=0.585g。
故原白色固体中还含有NaNO3,其质量为:1g-0.585g=0.415g。
【解析】此题考查了有关化学计算知识。(1)实验中不能用稀盐酸代替稀硝酸的原因是:防止稀盐酸与AgNO3溶液反应,对判断是否含有NaCl造成干扰;(2)滴加Ba(NO3)2的目的是:检验白色固体中是否含有Na2SO4;(3)通过计算推断:原白色固体的成分为:NaCl:0.585g 、NaNO3:0.415g。
解:原白色固体中氯化钠的质量为x。
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 1.435g,列比例式: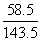 =
=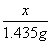 ,解得:x=0.585g。
,解得:x=0.585g。
故原白色固体中还含有NaNO3,其质量为:1g-0.585g=0.415g。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
2010年诺贝尔化学奖研究理论,帮助化学家合成开发出更多更复杂的有机物,生活中下列物质不属于有机物的是( )
A.醋酸(CH3COOH) B.碳酸钠(Na2CO3)
C.酒精(C2H5OH)  D.甲烷(CH4)
D.甲烷(CH4)
查看答案和解析>>
科目:初中化学 来源: 题型:
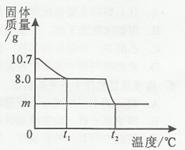
胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4·xH2O),华雪同学为研究CuSO4·xH2O加热后所得物质的组成,做了以下实验:取10.7g CuSO4·xH2O晶体加热使其分解,绘制出固休的质量随温度的变化关系图。如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:
CuSO4·xH2O CuSO4+ xH2O↑
CuSO4+ xH2O↑
(1)计算该硫酸铜晶体(CuSO4·xH2O)中x的值。
(CuSO4·xH2O的相对分子质量为:160+18x)
(2) CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m= g。 (写出求m的过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
将3.9克过氧化钠(Na2 O2)加入质量为63.9克的水中,完全反应后,在该溶液中加入50克稀盐酸,两者恰好完全反应:(提示:过氧化钠与水反应的化学方程式为:2Na2O2+2H2O===4NaOH+O2↑,不考虑氧气溶于水)
(1)反应生成氧气的质量为______克。
(2)计算最后所得溶液中溶质的质量分数。(请写出解题过程)
(3)若要使最后所得溶液中溶质的质量分数增加一倍,应将最后所得溶液蒸发掉
________________克水。
查看答案和解析>>
科目:初中化学 来源: 题型:
某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
| 稀盐酸的质量/g | 15 | 30 | 45 | 60 |
| 生成气体的质量/g | 1.8 | n | 4.4 | 4.4 |
(1)第Ⅱ组数据n为 _________ g.
(2)混合溶液中碳酸钠的质量分数是多少?(写出计算过程,结果精确至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液,然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴人盐酸的质量关系如图所示。请回答下列问肠:
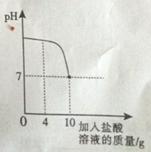
(1)配制8g 10%的NaOH溶液,需要水的质量为
(2)计算该盐酸的溶质质量分数;(写出计算过程)
(3)当滴人4g盐酸时,烧杯内溶液中钠元素的质量为 g
查看答案和解析>>
科目:初中化学 来源: 题型:
菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究,取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了1.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
查看答案和解析>>
科目:初中化学 来源: 题型:
钙是维持人体正常功能所必须的元素,有时需要服用补钙满足人体需求。下图分别为两种补钙剂说明书的一部分。

请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足量的钙,才能避免 (填字母序号);
A.佝偻病或骨质疏松 B.贫血症 C.甲状腺肿大
(2)葡萄糖酸钙(C12H22O14Ca)的化学式量是 ;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为 ;
(4)每片金钙尔奇中含碳酸钙的质量为  mg;
mg;
(5)按照金钙尔奇说明书每日的补钙量,若该服用葡萄糖酸钙片,一日3次,一次应服用几片? 。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列说法中,正确的是( )
A.蛋白质受热或遇到浓硝酸等物质时生理活性也不会发生改变
B.无机盐是人体的主要供能物质
C.人体中缺乏钙、铁、碘元素会引起许多疾病,因此饮食中摄入的越多越好
D.提倡均衡饮食,按时进餐,不挑食、不偏食
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com