
科目:初中化学 来源: 题型:选择题
| A. | 将光亮的铜丝插入稀盐酸中,有气泡产生 | |
| B. | 铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 将人体呼出的气体倒入紫色石蕊试液中,试液变成红色 | |
| D. | 硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示同答下列问题.
甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示同答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 干冰放置在蒸发皿上,固体逐渐减少最后消失----升华 | |
| B. | 打开装有浓盐酸的试剂瓶瓶盖,瓶口出现白雾----挥发 | |
| C. | 用洗涤剂洗去餐具上的油污----溶解 | |
| D. | 利用沸点的差异,从石油中分离各组分----分馏 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
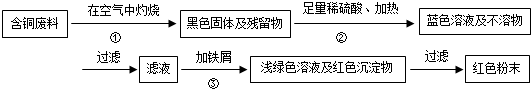

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁 铜 金 | B. | 金 铜 铁 | C. | 铜 铁 金 | D. | 铁 金 铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com