
| 2个氧原子 | 4个水分子 | 5个亚铁离子 | 6个铵根离子 |
| 2H | 4H2O | 5Fe2+ | 6N${{H}_{4}}^{+}$ |
| 用途 | 用于除去铁锈 | 天然气的主要成分 | 作为调味品 | 用于改良酸性土壤 | 烹制糕点所用发酵粉的主要成分化学式 |
| 化学式 | H2SO4 | CH4 | NaCl | Ca(OH)2 | NaHCO3 |
分析 (1)根据原子的表示方法:用元素符号来表示一个原子,表示多个原子,就在其元素符号前加上相应的数字进行分析;
根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字进行分析;
根据离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字进行分析;
(2)①根据物质的性质确定物质的用途,并能根据物质的名称正确书写物质的化学式,硫酸能和铁锈反应,天然气的主要成分是甲烷,氯化钠有咸味,可做调味品,改良酸性土壤用碱性物质,熟石灰呈碱性,碳酸氢钠能和酸反应生成二氧化碳气体进行分析;
②根据一氧化碳会与血红蛋白结合,导致携氧能力下降,铁会与硫酸铜反应,氢氧化钠会与油污反应生成小颗粒的物质,小麦出现倒伏现象,可施钾肥进行分析;
(3)①根据分子的性质,酸能使石蕊变红色进行分析;
②根据洗洁精能乳化油污进行分析;
③根据灭火的原理进行分析;
④根据牛奶中富含的营养素是蛋白质,聚乙烯塑料属于合成有机高分子材料进行分析.
解答 解:(1)通过原子的表示方法:用元素符号来表示一个原子,表示多个原子,就在其元素符号前加上相应的数字;分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字;离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字可知
| 2个氧原子 | 4个水分子 | 5个亚铁离子 | 6个铵根离子 |
| 2H | 4H2O | 5Fe2+ | 6N${{H}_{4}}^{+}$ |
| 用途 | 用于除去铁锈 | 天然气的主要成分 | 作为调味品 | 用于改良酸性土壤 | 烹制糕点所用发酵粉的主要成分化学式 |
| 化学式 | H2SO4 | CH4 | NaCl | Ca(OH)2 | NaHCO3 |
| 2个氧原子 | 4个水分子 | 5个亚铁离子 | 6个铵根离子 |
| 2H | 4H2O | 5Fe2+ | 6N${{H}_{4}}^{+}$ |
| 用途 | 用于除去铁锈 | 天然气的主要成分 | 作为调味品 | 用于改良酸性土壤 | 烹制糕点所用发酵粉的主要成分化学式 |
| 化学式 | H2SO4 | CH4 | NaCl | Ca(OH)2 | NaHCO3 |
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
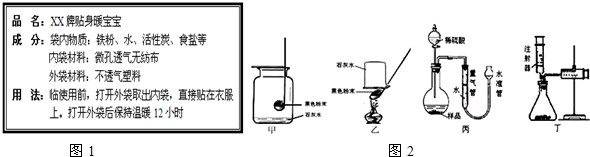
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,将A袋按使用说明打开外袋取出内袋;而B袋不打开外袋.并将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度无明显变化. | “暖宝宝”发热是由于袋内物质与O2接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于两支试管中,分别加入适量稀盐酸. | A袋内物质部分溶解,产生黄色溶液;B袋内物质部分溶解,有气泡产生,浅绿色溶液. | 用化学方程式表示产生黄色溶液的反应: Fe2O3+6HCl=2FeCl3+3H2O |
| 得出结论:“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
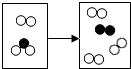 如图是密闭体系中某反应的微观示意图,“
如图是密闭体系中某反应的微观示意图,“ ”和“
”和“ ”分别表示微粒.
”分别表示微粒. B、
B、 C、
C、 D、
D、
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 方法 | 实验步骤依次编号 | 方程式 |
| 例: | A、B、H、G | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 元素关系 | 同列元素 | 未知元素X的相邻元素 | |||||
| 元素名称 | 钙 | 锶 | 钡 | 硅 | 镓 | 砷 | 锡 |
| 相对原子质量 | 40 | 88 | 137 | 28 | 70 | 75 | 119 |
| 密度(克/厘米3) | 1.55 | 2.60 | 3.62 | 2.40 | 5.89 | 5.72 | 7.30 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | MFe2Ox可用于环保 | |
| B. | 反应方程式中只有一种物质属于氧化物 | |
| C. | y的数值为4 | |
| D. | 该反应中只有硫元素的化合价发生了变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com