
| 小倩同学的解法 | 小明同学的解法 |
| 解:设生成的铝质量为X 2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ 204108 10t X $\frac{204}{108}$=$\frac{10t}{X}$ X=5.3t 答:最多可生产5.3t铝 | 解:氧化铝中铝元素的质量分数为 $\frac{Al的相对原子质量}{A{l}_{2}{O}_{2}的相对分子质量}$×100% $\frac{27×2}{27×2+16×3}$×100%=53% 铝的质量为10t×53%=5.3t 答:最多可生产5.3t铝 |
分析 ①小倩用的是“根据化学方程式的计算”,小明用的是根据元素的质量分数的计算,他们的解题思路和方法都正确;但小明的解题方法有局限性,只有在化合物分解后,要求的元素的质量没有被分解到两种物质中时才能使用;
②本题不能用小明的方法解答,因为过氧化氢完全分解后,氧元素没有都在氧气中,还有一部分在H2O中存在;
③由①和②的解题过程可知,小倩同学的解法在任何情况下都能使用;而只有在化合物分解后,要求的元素的质量没有被分解到两种物质中时才能使用小明同学的解法.
解答 解:①都正确,因为在电解过程中,氧化铝中的铝全部变成单质铝;
故答案为:都正确;因为在电解过程中,氧化铝中的铝全部变成单质铝;
②不能,因为过氧化氢分解时,过氧化氢是的氧没有全部转变成氧气,故只能用小倩的方法来解.
故答案为:不能;因为过氧化氢分解时,过氧化氢是的氧没有全部转变成氧气;
③解:设产生氧气的质量为x,
2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
34g x
$\frac{68}{32}=\frac{34g}{x}$
x=16g
答:产生氧气的质量为16g.
点评 本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:填空题
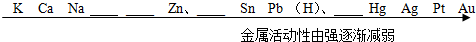
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 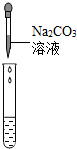 | 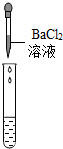 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.| 阳离子 | OH | N03- | C1- | SO42- | C03- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钡溶液 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 溶液变红色 | 该样品中含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
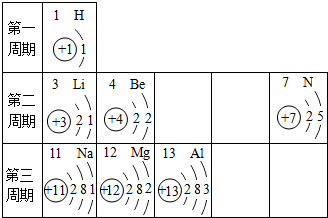
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定条件下,SO2和O2生成SO3,反应前后分子总数不变 | |
| B. | 煤燃烧后剩余残渣的质量减轻了 | |
| C. | 1克的氢气和1克的氧气完全燃烧,后生成2克的水 | |
| D. | 某有机物在空气中燃烧只生成CO2和H2O,则该有机物一定含有碳、氢、氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com