
| 实验 | 操作 | 现象 | 结论 |
| ① | a、用洁净干布擦已冷却铜片的黑色部分 | 黑色 物质不易被擦去 物质不易被擦去 |
该物质不是烟灰 该物质不是烟灰 |
| b、把铜片放在试管中加热 | 红 红 色变黑 黑 色 |
铜片与空气中的氧气发生反应的新物质 铜片与空气中的氧气发生反应的新物质 | |
② |
把铜片放在封口试管中,先加热铜片左端,变黑后逐渐右移,至不变黑后,再加热铜片最右端 | 右端不变黑 右端不变黑 |
没有氧气则铜片不会变黑 没有氧气则铜片不会变黑 |
| ||
| ||
| ||
| ||
| 实验 | 操作 | 现象 | 结论 |
| ① | 物质不易被擦去 | 该物质不是烟灰 | |
| 红;黑 | 铜片与空气中的氧气发生反应的新物质 | ||
② |
右端不变黑 | 没有氧气则铜片不会变黑 |
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
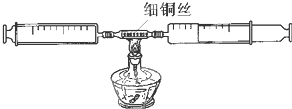 某兴趣小组的同学在学习了“金属铜化学性质的探究”之后,产生了灵感,设计了如下装置,探究“空气中氧气的含量”
某兴趣小组的同学在学习了“金属铜化学性质的探究”之后,产生了灵感,设计了如下装置,探究“空气中氧气的含量”| 加热 |
| 加热 |
| 反应前注射器内 气体的体积 |
反应后注射器内 气体的体积 |
消耗掉的 氧气的体积 |
| 1 |
| 5 |
| 1 |
| 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
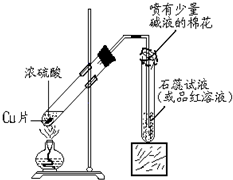 某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.
某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.| H2SO4(浓) |
| △ |
| O2 |
| △ |
| H2SO4(稀) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 操作 | 现象 | 结论 |
| ① | a、用洁净干布擦已冷却铜片的黑色部分 | 黑色______ | ______ |
| b、把铜片放在试管中加热 | ______色变______色 | ______ | |
② | 把铜片放在封口试管中,先加热铜片左端,变黑后逐渐右移,至不变黑后,再加热铜片最右端 | ______ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com