
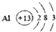
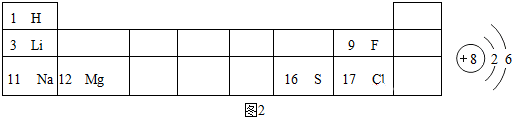
分析 (1)①根据铝的化学性质分析:②根据铝在周期表中位置分析;③根据铝地壳中含量分析;④根据铝的最外层电子数目的特点分析;⑤根据铝的原子结构分析判断;
(2)根据A1在高温条件下可以与Fe3O4发生罝换反应写出反应的化学方程式;
(3)根据固定变量法探究物质的性质的方法分析回答;
(4)根据金属活动性顺序表的应用分析判断;
(5)根据一氧化碳与氧化铁的反应、一氧化碳能污染空气分析回答.
解答 解:(1)①铝化学性质活泼,易与氧气反应形成致密的氧化铝薄膜,较耐腐蚀,故①正确;
②铝在周期表中的第三周期第ⅢA族,故②错误;
③铝是地壳中含量最多的金属元素,故③正确;
④铝的最外层电子数是3,小于4,在化学反应中易失电子,故④错误;
⑤铝的原子结构示意图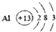 ,故⑤正确;
,故⑤正确;
(2)A1在高温条件下可以与Fe3O4发生罝换反应生成了铁和氧化铝,其反应的化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
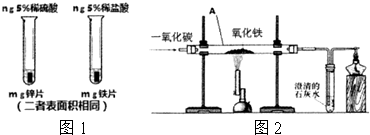
(3)从图可以看出,选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
(4)根据在金属活动性顺序中,铝>锌>铁>氢>铜>银,故锌、铁不能与Al(NO3)3溶液反应,而锌能先与硝酸银反应生成银和硝酸锌溶液,当硝酸银完全反应后,再与和硝酸铜溶液反应生成铜和硝酸锌溶液;当锌完全反应,铁再先后与硝酸银和硝酸铜反应,由过滤后往滤液中加稀盐酸无明显现象,说明滤液中不含硝酸银,无法确定Cu(NO3)2、铁反应的情况,故滤渣中一定会有银,滤液中一定含有的溶质是 Al(NO3)3、Zn(NO3)2.
(5)①在高温条件下,一氧化碳能与氧化铁反应生成了铁和二氧化碳,所以A中观察到的现象是:红色粉末变成黑色;
②由于尾气中含有一氧化碳能污染空气,所以右边导气管口放置点燃的酒精灯的目的是防止一氧化碳污染空气;
③设该赤铁矿样品中氧化铁的质量为x.
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 减少量
160 112 160-112=48
x 20g-15.2g=4.8g
$\frac{160}{48}=\frac{x}{4.8g}$ 解得:x=16g
该赤铁矿样品中氧化铁的质量分数:$\frac{16g}{20g}×100%$=80%
故答为:(1)①③⑤;(2)8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;(3)选取酸的种类不同(4)Al(NO3)3、Zn(NO3)2,银;(5)①红色粉末变成黑色;②防止一氧化碳污染空气;③赤铁矿样品中氧化铁的质量分数为80%.
点评 本题考查来的金属的知识比较多,都属于课本中的基础知识,难度不大,根据已有的知识分析解答即可.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
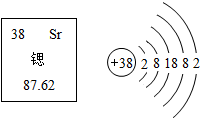 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动,汽轮机发电,锶元素在元素周期表中显示的信息和锶原子的结构示意图如图所示,下列说法正确的是( )
核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动,汽轮机发电,锶元素在元素周期表中显示的信息和锶原子的结构示意图如图所示,下列说法正确的是( )| A. | Sr为非金属元素 | B. | 锶原子的中子数是38 | ||
| C. | 锶原子的质量为87.62g | D. | 锶在化学反应中易失去2个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸碱中和反应都能生成水的实质是H+与OH-结合生成了H2O | |
| B. | 石油气加压后可贮存在钢瓶中,说明气体分子之间有间隙液体分子之间无间隔 | |
| C. | 有化合价升降的反应是氧化还原反应,则氧化还原反应中一定有电子的转移 | |
| D. | 湿衣服晾在太阳下干得快,说明分子运动速率与温度有关 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.
水是生命之源,它与我们的生活密切相关.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用灼烧法可以鉴别羊毛和合成纤维 | |
| B. | 催化剂一定能加快化学反应的速率 | |
| C. | 碳酸氢钠是焙制糕点的发酵粉的主要成分之一 | |
| D. | 洗涤剂具有乳化功能可除去油污 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 化合反应一定是氧化反应 | |
| B. | 有氧气参加的反应一定是氧化反应 | |
| C. | 化合反应中,如果有氧气参加,该反应既是化合反应,也是氧化反应 | |
| D. | 氧化反应中一定有氧气参加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com