
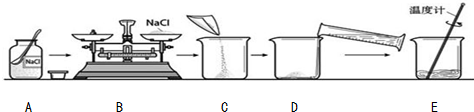
分析 (1)根据配制溶液时的注意事项分析解答;
(2)据天平称量左物右码,放反了所称物体的质量就是砝码减游码进行计算解答;
(3)根据溶剂质量=溶液质量-溶质质量求出蒸馏水的质量,进而确定所选量筒的规格,根据量筒的使用方法进行分析;
(4)根据溶解操作中玻璃棒的作用,进行分析解答;
(5)根据溶液的质量分数的计算公式来结合题给的选项进行选择;
(6)根据玻璃仪器洗涤干净的标准解答.
解答 解:(1)根据图示可知:A中瓶塞正放;B中物和砝码放反;E中用温度计搅拌;还缺少一个操作步骤是装瓶保存,贴标签;故填:3;装瓶贴标签;
(2)溶质的质量=溶质质量分数×溶液的质量,则需要氯化钠的质量为50g×15%=7.5g.B操作砝码7g,游码0.5g,药品实际质量为:7g-0.5g=6.5g;放好砝码和游码后,向托盘上加氯化钠时,若指针偏向分度盘的左边说明取用的氯化钠少,所以再加氯化钠,故答案:6.5;继续向左盘加食盐;
(3)所需蒸馏水的质量=50g-2.5g=47.5g;水的密度为1g/cm3,根据质量和体积之间的关系计算,V=47.5cm3=47.5mL;选取量筒时,尽量选用能一次量取的最小规格的量筒,所以量取47.5mL水应选用50mL的量筒,量筒读数时视线要与量筒内液体的凹液面的最低处保持水平;
故填:50mL;最低;
(4)E操作的后果是将温度计的玻璃泡碰碎;E操作的目的是搅拌,加速食盐溶解,故填:易将温度计的水银球损破,从而污染溶液; 加快溶解;
(5)所取食盐质量偏小或所取水的体积偏大是导致所配制溶液的溶质质量分数偏低的两个原因.若B操作正确,C操作有固体洒落会导致所取溶质偏小;把量好的水倒入烧杯时水测出导致水的体积偏小;溶液溅出对溶质的质量分数无影响;量取水时采取仰视而导致所取水的体积偏大;故填:①④;
(6)玻璃仪器洗涤干净的标准是:内壁附着的水既不成水滴,也不成股流下,故答案:洗过的玻璃仪器内壁附着的水既不成水滴,也不成股流下时,表示玻璃仪器已经洗干净.
点评 本题考查了溶液的配制,完成此类题目,可以依据课本已有知识进行回答,所以要求同学们在平时的学习中要加强知识的储备,能够灵活的应用.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加足量稀盐酸,并不断振荡. | 有气泡冒出 | 该反应的方程式为 2HCl+Na2CO3═2NaCl+H2O+CO2↑,由此可知该氢氧化钠溶液一定变质了. |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有白色沉淀 | 说明原溶液中一定有碳酸钠. 写出该反应的化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色 | 说明原溶液中一定有氢氧化钠. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ 质量分数/% | 20 | 40 | 60 |
| 4 | 1.023 | 1.016 | 1.007 |
| 10 | 1.063 | 1.054 | 1.044 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如下图所示.
已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如下图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
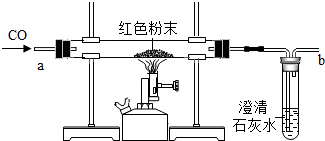 在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.| 实验中可能出现的现象 | 结论 |
| 假设1成立 | |
| 假设2成立 | |
| 假设3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用食醋除去水壶中的水垢 | |
| B. | 玻璃窗破裂 | |
| C. | 自来水通过蒸馏变成可饮用的瓶装水 | |
| D. | 用活性炭除去冰箱中的异味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com