
【题目】下列图像能正确反映其对应关系的是( )
A.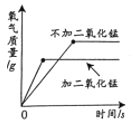 完全分解等质量等浓度的过氧化氢溶液
完全分解等质量等浓度的过氧化氢溶液
B.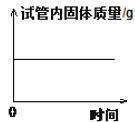 在试管中加热高锰酸钾
在试管中加热高锰酸钾
C.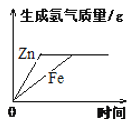 等质量的锌粉和铁粉与足量的稀硫酸反应
等质量的锌粉和铁粉与足量的稀硫酸反应
D.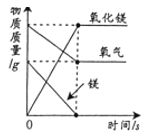 一定量的镁在过量的氧气中充分燃烧
一定量的镁在过量的氧气中充分燃烧
【答案】D
【解析】
A、完全分解等质量等浓度的过氧化氢溶液,加二氧化锰的反应速率快,但是最后生成氧气的质量相同,不符合题意;
B、在试管中加热高锰酸钾,高锰酸钾在加热的条件下分解为锰酸钾、二氧化锰和氧气,有氧气生成,固体质量逐渐减少,待高锰酸钾完全反应后,固体质量不再变化,不符合题意;
C、等质量的锌粉和铁粉与足量的稀硫酸反应,锌比铁活泼,反应速率快,锌与稀硫酸反应:![]() ,铁与稀硫酸反应:
,铁与稀硫酸反应:![]() ,等质量的锌粉和铁粉与足量稀硫酸反应,锌的相对原子质量大于铁,最后,铁生成的氢气多,不符合题意;
,等质量的锌粉和铁粉与足量稀硫酸反应,锌的相对原子质量大于铁,最后,铁生成的氢气多,不符合题意;
D、一定量的镁在过量的氧气中充分燃烧,镁与氧气反应生成氧化镁,随着反应的进行,镁的质量逐渐减小至零,氧化镁的质量逐渐增加,待镁完全反应后,质量不再变化,氧气的质量逐渐减小,待镁完全反应后,不再变化,氧气过量,故氧气不会减小至零,符合题意。
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】根据下列实验室制取和收集气体的装置图,回答有关问题。
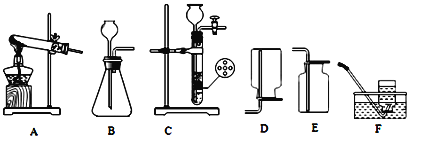
(1)实验室常用高锰酸钾固体制取氧气,应选用的发生装置和收集装置是_____。
(2)实验室制取二氧化碳的化学方程式是_____,与B装置相比,使用C装置多孔隔板的优点是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2013年10月,国务院出台了《关于化解产能严重过剩矛盾的指导意见》,将改革重点锁定钢铁、电解铝等五大严重产能过剩行业,河北省调整钢铁产业结构,化解钢铁产能矛盾。则回答:
(1)铁的合金有两种,分别是生铁和______,两者的区别在于_____不同,都属于______(填“纯净物”或“混合物”)
(2)钢铁是我们日常生活中使用最多的金属材料。炼铁过程中,一氧化碳和赤铁矿(主要成分为Fe2O3)反应,则反应的化学方程式为__________________。
(3)我国早在春秋战国时期就开始使用铁器。钢铁的锈蚀所造成的损失是惊人的数据。铁在空气中锈蚀,实际上是铁跟空气中的____和____共同作用的结果。为了防止钢铁锈蚀,请你说明防止铁制品锈蚀的一种措施有______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):

回答下列问题:
(1)操作a的名称是_______________。
(2)反应②的化学方程式为________________________。
(3)反应④的化学方程式为___________________;请列举小苏打在生活中的一种常见用途_______________________。
(4)向精制饱和食盐水中通入两种气体的顺序是:先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。这样操作的目的是___________________________。
(5)仔细观察流程图,其中可循环利用的物质除二氧化碳之外,还有___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】马铃薯具有谷物和蔬菜的双重营养价值,被誉为“营养之王”,马铃薯脂肪含量低,蛋白质品质高,还富含淀粉,淀粉是天然有机高分子化合物,其化学式为(C6H10O5)n ,其中n为几百至几千,淀粉的相对分子质量从几万到几十万。请回答下列问题:
(1)淀粉中碳、氢、氧三种元素的质量比为________(填最简整数比);
(2)淀粉中含量最大的元素名称为____,其质量分数为_____(计算结果精确到0.1%);
(3)科学家使用由多种特殊的酶组成的催化剂,将淀粉和水转变成CO2和H2的混合气体,净化获取的氢气作为未来氢动力汽车燃料。请写出淀粉与水反应的化学方程式:____________。
(4)取用优质的马铃薯样品,从中切去2个相同质量的A、B正方体土豆块,再将B土豆块切成若干片,且片与片相连不断开,同时分别放入盛30mL5%过氧化氢溶液的50mL量筒中,均看到有气泡生成,当一段时间之后,只有B样品土豆片不断上升,通过该对比实验得出的结论是:①___________;②_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验数据合理的是( )
A.用托盘天平称得某纯碱样品的质量为10.57g
B.用10mL量筒量取了6.53mL水
C.用20g氯化钠和100g水配制成的120g食盐水,其溶质质量分数为20%
D.用pH试纸测得某地雨水的pH值为5
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】武汉举行首届中国国际钢铁流通博览会,将商讨全球金属流通行业的战略性问题。则回答:
(1)金属材料的生产和使用是人类文明和社会进步的重要标志。常见三种金属铜、铁和铝被先后大规模的发现与使用,则其中的原因是(_____)
A 地壳中金属元素的含量 B 金属的导电性
C 金属的活动性顺序 D 金属的资源与价格
(2)大型钢铁企业常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,相关系列的化学反应过程如下:
![]()
请写出第①②步反应的化学方程式分别为_______________和__________。第③步反应的反应现象为______________________________。
(3)金属矿物的储量有限,而且不能再生。目前世界上已有50%以上的废钢铁得到回收利用,请说明其目的是________(填“合理开采矿物”、“节约金属资源”或“开发出金属的代用品”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在实验室用下图装置制取氧气。
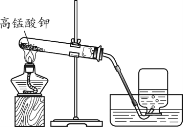
(1)加热高锰酸钾时,试管口略向下倾斜的原因是______。
实验后,同学们发现沾有高锰酸钾的白抹布洗完晾干后变为棕褐色。
(查阅资料)
草酸溶液能将棕褐色物质除去。
(提出问题)
哪些因素能加快草酸除去棕褐色物质的速率?
(进行实验)
将均匀染有棕褐色的抹布剪成大小相同的小布条进行实验
实验 编号 | 实验1
20℃ 水 | 实验2
20℃ 0.5%草酸溶液 | 实验3
20℃ 0.25%草酸溶液 | 实验4
20℃ 0.125%草酸溶液 | 实验5
30℃ 0.25%草酸溶液 | 实验6
40℃ 0.25%草酸溶液 |
现象 | 颜色 没有褪去 | 70秒后 颜色褪去 | 98秒后 颜色褪去 | 150秒后 颜色褪去 | 51秒后 颜色褪去 | 40秒后 颜色褪去 |
(解释与结论)
(2)配制200g溶质质量分数为 0.5%的草酸溶液,需要草酸的质量为______。
(3)实验1的目的是______。
(4)证明升高温度能加快草酸除去棕褐色物质的速率,需要对比______(填实验序号)。
(5)由实验2、3、4可以得出的结论是______。
(反思与评价)
(6)实验后,同学们查资料得知抹布上的棕褐色物质为二氧化锰,请你设计实验方案进行验证______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外小组的同学想通过实验探究水的组成,请你一起参与探究过程,并填写下列空白。
(做出猜想)水中含有氢元素和氧元素。
(设计并进行实验)小组同学合作制作了如图所示的简易电解水装置。

(1)实验前往水中加入氢氧化钠的目的是_____。
(2)B试管中收集到的气体是_____,燃烧会产生_____色的火焰。
(3)写出氢气与氧气反应的符号表达式:_____。
(得出结论)通过实验得到的结论为水是由_____组成的。
(反思与评价)
(1)研究物质组成的方法是:根据化学反应前后_____不变的原理,设计实验让物质参与一个化学反应,通过分析反应物或生成物的元素组成进一步确定该物质的组成。
(2)在实验过程中,某同学发现刚开始的一段时间内阴、阳两极产生的气体体积之比大于2∶1,其可能原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com