
下列操作能导致原溶液的pH降低的是
A.向稀盐酸中逐滴加入稀NaOH溶液
B.向氢氧化钠溶液中加入水
C.向稀NaOH溶液中滴加盐酸
D.向稀盐酸溶液中滴加水
科目:初中化学 来源: 题型:阅读理解
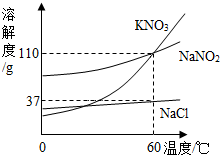 (2013?历下区二模)亚硝酸钠(NaNO2)常用作食品的发色剂和防腐剂,但食品中的亚硝酸钠含量超标会危害人体健康.亚硝酸钠具有咸味,外形和食盐很相似,亚硝酸钠的水溶液呈碱性.建筑行业常用亚硝酸钠作水泥添加剂,近年来,在建筑工地多次发生误将亚硝酸钠当作食盐食用导致中毒的事件.
(2013?历下区二模)亚硝酸钠(NaNO2)常用作食品的发色剂和防腐剂,但食品中的亚硝酸钠含量超标会危害人体健康.亚硝酸钠具有咸味,外形和食盐很相似,亚硝酸钠的水溶液呈碱性.建筑行业常用亚硝酸钠作水泥添加剂,近年来,在建筑工地多次发生误将亚硝酸钠当作食盐食用导致中毒的事件.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com