
 某硫酸化工厂附近居民反映:近来空气中有异味,庄稼枯黄,某学习小组对该厂附近的雨水进行检测,测得pH约为5.1,说明该区域的雨水呈酸性(填“酸性”或“碱性”或“中性”)
某硫酸化工厂附近居民反映:近来空气中有异味,庄稼枯黄,某学习小组对该厂附近的雨水进行检测,测得pH约为5.1,说明该区域的雨水呈酸性(填“酸性”或“碱性”或“中性”)分析 根据溶液的pH<7时,显酸性,pH=7时,显中性,pH>7时,显碱性解答;
根据氢氧化钙能够吸收空气中的二氧化硫,并且和二氧化硫反应生成亚硫酸钙和水解答.
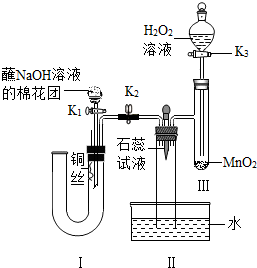
[实验探究]
(1)根据质量守恒定律解答;根据本题实验Ⅱ中的意图是创设无氧气环境,用稀硝酸溶液排除U形管内的空气,铜丝与硝酸反应后,生成的NO难溶于硝酸溶液,导致U形管的压强增大,硝酸溶液被压到U形管右侧,当硝酸和铜丝脱离接触,反应自动停止解答;
(2)再打开K3,若观察到长玻璃管中气体迅速变为红棕色解答;根据双氧水在二氧化锰的催化作用下反应生成O2解答;
(3)根据反应原理写出反应的化学方程式解答.
解答 解:测得pH约为5.1,说明该区域的雨水呈酸性;
氢氧化钙能够吸收空气中的二氧化硫,并且和二氧化硫反应生成亚硫酸钙和水,反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O.
[实验探究]
(1)由反应原理可知:
反应前:Cu、H、N、O的原子个数分别为:3、8、8、24;反应后:Cu、H、N、O的原子个数分别为:3、8、0、20;则4x中有8个氢原子和4个氧原子,为
H2O;用稀硝酸溶液排除U形管内的空气,铜丝与硝酸反应后,生成的NO难溶于硝酸溶液,导致U形管的压强增大,硝酸溶液被压到U形管右侧,当硝酸和铜丝脱离接触,反应自动停止;
(2)打开K2,当无底试管内的气体颜色不再变化后,关闭K2.再打开K3,双氧水在二氧化锰的催化作用下反应生成O2,NO和O2在Ⅱ中发生反应,2NO+O2=2NO2;一段时间后,关闭K3,观察到无底试管内气体颜色的变化为无色变为红色,水吸收水NO2生产HNO3,向无底试管中加紫色石蕊试液,溶液呈蓝色;
Ⅲ中双氧水在二氧化锰的催化作用下反应生成O2,2H2O2$\frac{\underline{\;高温\;}}{\;}$2H2O+O2↑;
(3)当NO与O2的化学计量数之比为4:3时,它们能被水完全吸收生成HNO3.其化学方程式为:4NO+3O2+2H2O═4HNO3
答案:
酸性;
Ca(OH)2+SO2═CaSO3↓+H2O.
[实验探究]
(1)H2O;用稀硝酸溶液排除U形管内的空气,铜丝与硝酸反应后,生成的NO难溶于硝酸溶液,导致U形管的压强增大,硝酸溶液被压到U形管右侧,当硝酸和铜丝脱离接触,反应自动停止;
(2)无色变为红色;红;2H2O2$\frac{\underline{\;高温\;}}{\;}$2H2O+O2↑;
(3)4NO+3O2+2H2O═4HNO3
点评 本题考查制备实验的设计,题目难度中等,注意把握实验的操作方法和反应原理,注意观察NO的现象必须在无氧的环境中进行.碱具有一些相似的化学性质,例如能和酸碱指示剂反应,能和某些非金属氧化物反应,能和某些盐反应,能和碱反应等.


科目:初中化学 来源: 题型:选择题
| A. | 火山是地壳运动的表现形式之一 | |
| B. | 人类活动是导致火山喷发的主要原因 | |
| C. | 冰川熔化时需要吸收大量的热 | |
| D. | 喷出的二氧化硫会导致酸雨增多 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 序号 | ① | ② | ③ |
| 化学式或 离子符号 | N2 | ||
| 化学名称 | 氢氧根离子 | 碳酸氢钠 |
| 物质 | A | B | C | D |  |
微观 示意图 |  |  |  |  |
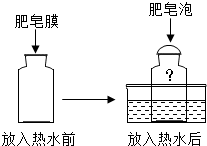
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
| 剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 | 2.04 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
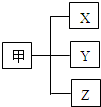 归类是我们经常用到的一种学习方法.若用如图所示的形式对所学知识进行归类,则表中的选项与图相符的是( )
归类是我们经常用到的一种学习方法.若用如图所示的形式对所学知识进行归类,则表中的选项与图相符的是( ) | 选项 | 甲 | X | Y | Z |
| A | 常见的碱 | 烧碱 | 纯碱 | 熟石灰 |
| B | 常见的矿物燃料 | 煤 | 石油 | 天然气 |
| C | 常见的合金 | 钢铁 | 生铁 | 氧化铁 |
| D | 常见的行星 | 地球 | 太阳 | 月球 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验设计 | 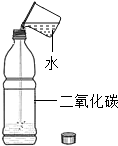 |  |  |  |
| 实验目的 | 验证二氧化碳与水反应生成碳酸 | 探究水的组成 | 证明石墨有导电性 | 验证氢气的密度比空气小 |
| 选项 | A | B | C | D |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 1.取烧杯M中的少量溶液于试管A中,向其中加入一定量的稀盐酸 | 溶液由红色变为无色且有气泡产生. | 小红 的猜想不正确 |
| 2.另取烧杯M中的少量溶液于另一试管B中,向其中加入过量氯化钡溶液. | 出现白色沉淀 | 小亮的猜想正确 |
| 3.继续向试管B中加入过量的稀盐酸 | 沉淀一部分消失,并生成气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 反应时间(秒) | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
| 滴入稀盐酸体积(毫升) | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
| 温度(℃) | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com