
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 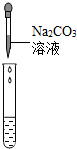 | 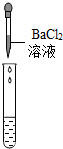 |
| 实验现象 | 试纸变色,对比比色卡,pH=1 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
分析 【学生板演】根据氢氧化钠和硫酸反应生成硫酸钠和水进行分析;
【假设猜想】根据氢氧化钠和稀硫酸反应生成硫酸钠和水,稀硫酸和氢氧化钠不能共存;
【实验探究】
(1)根据硫酸铜能和氢氧化钠反应生成蓝色沉淀氢氧化铜和硫酸钠进行分析;
【评价反思】测定溶液pH的方法是:用洁净干燥的玻璃棒蘸取处理后的废水,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH;
根据稀硫酸、硫酸钠都能够和BaCl2溶液反应生成硫酸钡沉淀进行分析.
解答 解:【学生板演】氢氧化钠和硫酸反应生成硫酸钠和水,化学方程式为:H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】因为氢氧化钠和稀硫酸反应生成硫酸钠和水,所以猜想四应为:有Na2SO4和NaOH;
因为氢氧化钠和稀硫酸反应生成硫酸钠和水,所以稀硫酸和氢氧化钠不能共存,因此猜想三不合理;
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠;
【评价反思】(1)实验操作中的错误是:把pH试纸浸入溶液中;
(2)实验方案中也有一个是错误的,错误的原因是硫酸钠也能够和氯化钡反应生成硫酸钡沉淀,因此向溶液中加入氯化钡溶液时产生白色沉淀,不能说明溶液中一定含有稀硫酸.
故答案为:【学生板演】H2SO4+2NaOH═Na2SO4+2H2O;
【假设猜想】Na2SO4和NaOH;
三,稀硫酸和氢氧化钠不能共存;
【实验探究】(1)氢氧化钠;
【评价反思】(1)把pH试纸浸入溶液中;
(2)硫酸钠也能够和氯化钡反应生成硫酸钡沉淀.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 测定空气中氧气的含量时,可以使用白磷 | |
| B. | 做铁丝在氧气中燃烧实验时,预先在集气瓶中加少量水 | |
| C. | 稀释浓硫酸时,将浓硫酸注入盛水的量筒中 | |
| D. | 给烧杯中的液体加热时应使用石棉网 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 混合物、氧化物、盐 | B. | 混合物、盐、化合物 | ||
| C. | 单质、混合物、盐 | D. | 金属单质、氧化物、纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 铜、铁、铝是生产生活中广泛使用的金属.
铜、铁、铝是生产生活中广泛使用的金属.查看答案和解析>>
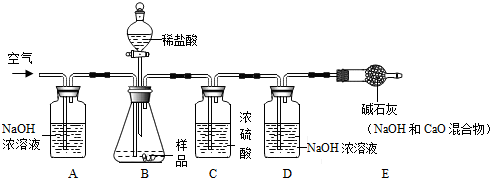
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是:氢氧化钠固体.溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是Na2CO3. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀现象 | 样品中还含有的杂质是NaCl. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 选项 | A | B | C | D |
| 实验目的 | 除去CO2中的CO | 证明醋酸呈酸性 | 鉴别硫酸钾和硝酸铵固体 | 除去CaCl2溶液中的盐酸 |
| 选用试剂或方法 | 点燃 | 加无色酚酞 | 加热石灰研磨 | 加碳酸钙足量(其他合理答案均可) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com