
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热 | 量简中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A.AB.BC.CD.D
科目:初中化学 来源: 题型:
【题目】下图是电解水的装置,结合所学知识,完成下列问题:
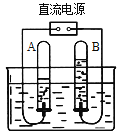
(1)其中A试管应该与电极的_________极(填正或负)相连。通电一段时间后,B试管中收集到的气体是_______,那么,A试管和B试管中收集到的气体的体积比约等于_________、分子个数比是__________、质量比是___________。
(2)B试管中气体的检验方法为___________________。
(3)通过该实验小明得出了许多结论,请你说出其中一条:______________。
(4)写出该反应的符号表达式_____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表中第118号元素![]() 是最新公布中文名称的元素,该元素相关信息如图所示。下列说法正确的是( )
是最新公布中文名称的元素,该元素相关信息如图所示。下列说法正确的是( )
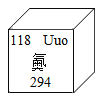
A. 该元素的元素符号为Uu
B. 该元素是金属元素
C. 该元素原子的质子数为176
D. 该元素的原子序数为118
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,图1是元素周期表中的一部分,图2是硒原子的结构示意图。下列说法不正确的是( )
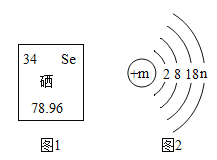
A. 图2中m的值为34,n的值为6
B. 硒元素位于元素周期表中第四周期
C. 硒化钠的化学式为Na2Se
D. 亚硒酸钠的化学式为Na2SeO3,其中硒元素的化合价为+6
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】发展低碳经济,降低碳排放,就是要尽量减少温室气体二氧化碳的排放!下图是部分物质与二氧化碳的相互转化关系,请回答下列问题:
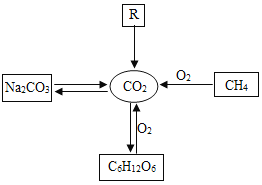
(1)碳酸钠在高温下与SiO2发生反应,化学方程式为: Na2CO3+SiO2![]() Na2SiO3 + CO2↑,Na2SiO3中硅元素的化合价为______价;
Na2SiO3 + CO2↑,Na2SiO3中硅元素的化合价为______价;
(2)葡萄糖在酶的催化作用下缓慢氧化可转变为二氧化碳,其原理可以表示为:C6H12O6 +6O2 ![]() 6CO2 + 6X,其中X的化学式为____;
6CO2 + 6X,其中X的化学式为____;
(3)物质R能发生分解反应生成CO2,写出一个符合要求的化学方程式____;
(4)甲烷是天然气的主要成分,甲烷(CH4)、乙烷(C2H6)、丙烷、丁烷(C4H10)等物质都属于有机物中的烷烃,写出丙烷燃烧的化学方程式____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示装置可用于测定空气中氧气的含量。
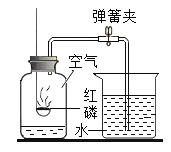
(1)红磷在空气中燃烧的符号表达式为___________________。
(2)实验前在集气瓶内加入少量水,并做上记号,再将上方空气分为五等分。红磷熄灭并_____________后,才能打开弹簧夹。
(3)打开弹簧夹后,烧杯中水沿导管进入瓶中,进水体积约占瓶中空气体积的______________。
(4)若红磷的加得过少,实验的结果会______________(填“偏大”或“偏小”或“不变”)。
(5)不能用铁丝代替红磷来进行实验,是因为___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如下图。
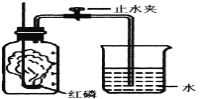
该同学的实验步骤如下:
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)该实验中红磷需稍过量,目的是 。
(2)步骤③中打开止水夹后观察到的现象是 ,由此可得出空气中氧气的体积分数约为 。
(3)磷在空气中燃烧生成的氧化物通常可作强干燥剂。己知在标准状况下,32g氧气的体积是22.4L,在该条件下,制备71g这种干燥剂所消耗的空气的体积约为 L。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于燃烧现象的解释或分析正确的是( )
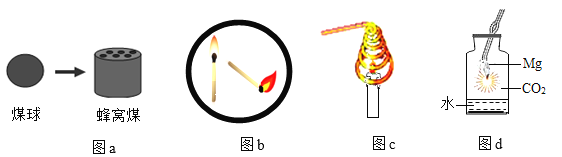
A. 图a中将煤球变成蜂窝煤后再燃烧,其目的是延长煤燃烧的时间
B. 图b中火柴头斜向下时更容易燃烧,是因为降低了火柴梗的着火点
C. 图c中蜡烛火焰很快熄灭,是因为金属丝阻碍空气的流动
D. 由图d中的现象可知,金属镁燃烧的火灾不能用二氧化碳灭火
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小亮同学想通过实验探究某企业采用的氨碱法制的纯碱样品的成分及含量。
[提出问题1]①该纯碱样品中含有哪些物质?
[猜想与假设]通过分析,小亮做出如下假设:
(1)只含有Na2CO3;(2)含有Na2CO3和NaHCO3
[查阅资料]
NaHCO3 | Na2CO3 | |
加入稀盐酸 | 现象I | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象Ⅱ为___________;
(2)现象I对应的化学方程式为_________。
[实验探究]为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告。
实验步骤 | 实验现象 | |
①取少量样品溶于水,加入过量的CaCl2溶液 | 溶液变浑浊 | 该反应的化学方程式:___________; |
②将上述反应后的混合液过滤,取滤液_______; | _______; | 证明猜想②成立。 |
[实验反思]
实验步骤①中,加入试剂过量的目的是_______;
[提出问题2]如何测量该纯碱样品中各物质的含量?

(1)为测量该纯碱样品各成分的含量,小亮设计了如图装置,通过称量B装置中的质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有
①__________;②__________;
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:

①检查装置气密性;②将w g干燥的样品放入锥形瓶中;
③称量盛有氢氧化钠浓溶液的B瓶质量;
④打开活塞b,从导管a处缓缓注入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量计算样品中各成分的含量。
该实验的正确步骤是___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com