
| 56×2 |
| 56×2+16×3 |
| ||
| 160 |
| 48 |
| x |
| 10g-7.6g |


科目:初中化学 来源: 题型:
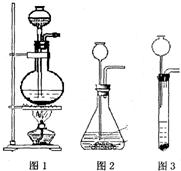 25、超氧化钾(KO2)是一种黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用它作制氧剂,供人们呼吸之用,它与二氧化碳反应的化学方程式为:4KO2+2CO2═2K2CO3+3O2,某学生为了验证这一实验,以大理石,足量的盐酸和超氧化钾为原料制取O2,设计如下实验装置:
25、超氧化钾(KO2)是一种黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用它作制氧剂,供人们呼吸之用,它与二氧化碳反应的化学方程式为:4KO2+2CO2═2K2CO3+3O2,某学生为了验证这一实验,以大理石,足量的盐酸和超氧化钾为原料制取O2,设计如下实验装置: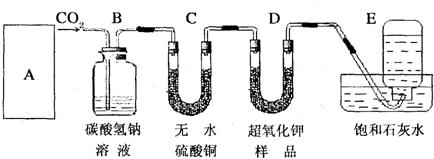
查看答案和解析>>
科目:初中化学 来源: 题型:
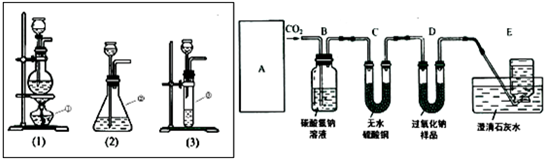
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验序号 | 实验操作 | 实验现象 | 实验结论 |
| 一 | 向盛有Na2O2粉末的玻璃管中,吹入气体 | 右边管口带火星木条复燃 | 反应产生了氧气 |
| 二 | 取实验一得到的白色固体溶于水,加入稀盐酸 | 白色固体溶解,并有气泡产生 | 固体成分中有碳酸钠 |
| 三 | 取白色固体的溶液,用pH试纸测定其pH | pH>7 | 固体中一定有NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com