
 如图是元素周期表的两种元素的信息,下列说法中正确的是( )
如图是元素周期表的两种元素的信息,下列说法中正确的是( )| A. | 两种元素都是非金属元素 | |
| B. | 一个金属原子质量比一个氟原子质量小 | |
| C. | 金原子的中子数为197 | |
| D. | 氟原子的核外电子数为9 |
科目:初中化学 来源: 题型:实验探究题
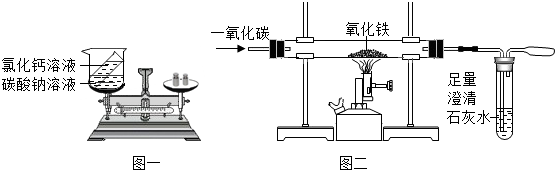
 已知木炭粉(假设木炭粉中不含其他杂质)和Fe2O3在高温条件下发生化学反应,兴趣小组同学对该实验进行如下探究.
已知木炭粉(假设木炭粉中不含其他杂质)和Fe2O3在高温条件下发生化学反应,兴趣小组同学对该实验进行如下探究.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验序号 | KClO3质量/g | 其他物质质量 | 待测数据 |
| ① | 1.5 | / | |
| ② | m | Fe2O3 0.5 | |
| ③ | 1.5 | CuO 0.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 方案 |
| A | 鉴别硝酸钠溶液和氢氧化钾溶液 | 取样,滴加MgCl2溶液,观察现象 |
| B | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、过滤、蒸发 |
| C | 除去KCl中的KClO3 | 加入MnO2后再加热到固体质量不变 |
| D | 检验氢气的纯度 | 收集一试管气体靠近明火移开拇指点燃,听声音 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2(CO)--点燃 | B. | CO2(HCl)--通过足量的氢氧化钠溶液 | ||
| C. | CaO(CaCO3)--高温充分煅烧 | D. | HCl溶液(CaCl2)--加过量的氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
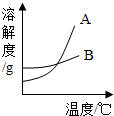 运用溶解度表与溶解度曲线图回答下列问题:
运用溶解度表与溶解度曲线图回答下列问题:| 温度/°C | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
| 碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A[ | 木炭燃烧能生成二氧化碳或一氧化碳 | 反应物的量不同生成物可能不同 |
| B | 双氧水能杀菌消毒而水则不能 | 两种物质的分子构成不同 |
| C | 公共场合吸烟会危害多数人的健康 | 分子在不断的运动 |
| D | 水银温度计受热时水银柱上升 | 汞原子体积变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com