
分析 碳酸钠俗称纯碱、苏打,是由钠离子和碳酸根离子组成的化合物,属于盐;
氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠;
碳酸钡能和稀硫酸反应生成硫酸钡、水和二氧化碳;
氯化钠和硫酸钠的水溶液显中性,碳酸钠的水溶液显碱性;
碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
根据提供的数据可以计算该溶液溶质的质量分数.
解答 解:【查阅资料】
碳酸钠俗称纯碱、苏打,属于盐,能溶于水,且水溶液呈碱性.
故填:盐.
【实验探究】
(1)取少量溶液,滴加BaCl2溶液,观察得到白色沉淀产生,由此可得到的结论是该物质是碳酸钠或硫酸钠,不是氯化钠.
(2)不能确定白色粉末为硫酸钠,如果白色粉末为碳酸钠,和氯化钡反应生成的碳酸钡沉淀和稀硫酸反应时,生成硫酸钡沉淀、水和二氧化碳,因此根据沉淀仍有剩余不能确定白色粉末为硫酸钠.
【实验反思】
(1)用PH试纸确定该物质可能含有的成分的方法是:把该物质溶于水配成溶液,用洁净干燥的玻璃棒蘸取溶液,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH,如果pH大于7,则该物质是碳酸钠,如果pH等于7,该物质是氯化钠或硫酸钠.
(2)向溶液滴加稀盐酸时,观察到有气泡产生,也说明该物质是碳酸钠,碳酸钠和稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
【综合计算】
设碳酸钠的质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106 197
x 19.7g
$\frac{106}{x}$=$\frac{197}{19.7g}$,
x=10.6g,
该溶液溶质的质量分数为:$\frac{10.6g}{50g}$×100%=21.2%,
答:该溶液溶质的质量分数为21.2%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | pH=0的溶液 | B. | pH=5的溶液 | C. | pH=7的溶液 | D. | pH=11的溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某研究性学习小组在协助老师清理实验室时,发现一批存放多年的氢氧化钙.为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,如图甲所示,振荡后读取质量.得到锥形瓶中物质的质量与稀盐酸质量关系,如图乙所示,试求:
某研究性学习小组在协助老师清理实验室时,发现一批存放多年的氢氧化钙.为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,如图甲所示,振荡后读取质量.得到锥形瓶中物质的质量与稀盐酸质量关系,如图乙所示,试求:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
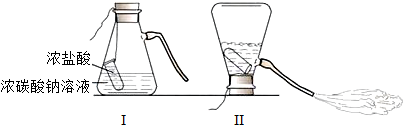 某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究.
某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com