
| 浓硫酸(H2SO4) 500毫升 | |
| 浓度(质量分数) | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 35、某同学在实验室进行了如图所示的实验.
35、某同学在实验室进行了如图所示的实验.查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验装置 | 实验步骤 | 分析 |
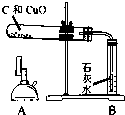 |
①检验装置气密性 | |
| ②把木炭和氧化铜的混合物放入试管,如左图所示连接实验装置 | 装置中存在的问题是 (1)B试管处不应该有橡皮塞 (1)B试管处不应该有橡皮塞 ; | |
| ③改进装置后,点燃酒精喷灯开始实验 | 装置B的作用是 (2)检验产物是否有二氧化碳 (2)检验产物是否有二氧化碳 ; | |
| ④反应结束时,先将导管从装置B中撤出,再停止加热 | 目的是 (3)防止液体倒流引起试管炸裂 (3)防止液体倒流引起试管炸裂 ; | |
| ⑤待试管冷却后将剩余固体M倒入烧杯,加入足量稀硫酸,过滤 | 得到蓝色滤液 滤渣为红色和黑色固体混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| 用一支玻璃棒蘸取少许澄清石灰水,放在产生气体的试管口 | 玻璃棒上有白色物质产生 | 化学方程式: Ca(OH)2+CO2═CaCO3↓+H2O Ca(OH)2+CO2═CaCO3↓+H2O 该气体是CO2,由此可判断该白色粉末中含有碳酸盐. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| 用一支玻璃棒蘸取少许澄清石灰 水,插入产生气体的试管中 |
玻璃棒上有白色的物质产生 | 方程式; CO2+Ca(OH)2═CaCO3↓+H2O CO2+Ca(OH)2═CaCO3↓+H2O 该气体是CO2,由此可判断该白色 粉末是碳酸盐 |
查看答案和解析>>
科目:初中化学 来源:虹口区二模 题型:问答题
| 实验装置 | 实验步骤 | 分析 |
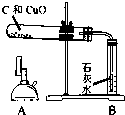 |
①检验装置气密性 | |
| ②把木炭和氧化铜的混合物放入试管,如左图所示连接实验装置 | 装置中存在的问题是______; | |
| ③改进装置后,点燃酒精喷灯开始实验 | 装置B的作用是______; | |
| ④反应结束时,先将导管从装置B中撤出,再停止加热 | 目的是______; | |
| ⑤待试管冷却后将剩余固体M倒入烧杯,加入足量稀硫酸,过滤 | 得到蓝色滤液 滤渣为红色和黑色固体混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com