
 如图是给病人输液用的氯化钠注射液的标签.
如图是给病人输液用的氯化钠注射液的标签.分析 (1)由标签可知,500毫升这种注射溶液含有氯化钠的质量为4.5g,1000mL÷500mL×4.5g就是需氯化钠的质量;
(2)根据氯化钠与硝酸银反应的化学方程式和生成氯化银沉淀的质量,列出比例式,就可计算出参与反应的氯化钠的质量,然后根据溶质质量分数公式即可计算出氯化钠注射溶液中氯化钠的质量分数.然后对照标签数据,即可判断是否达到要求.
解答 解:(1)1000mL÷500mL×4.5g=9g;
设需要加入氯化钠的质量为y
$\frac{100g×0.9%+y}{100g+y}$×100%=10%
y=0.11g
(2)设参与反应的氯化钠的质量为x,
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
x 1.435g
$\frac{58.5}{x}=\frac{143.5}{1.435g}$
解之得:x=0.585g,
氯化钠注射溶液的质量分数为:$\frac{0.585g}{65g}$×100%=0.9%.
对照标签可知,此氯化钠溶液的溶质质量分数为0.9%,NaCl的含量达到了要求.
答案:
(1)9;0.11;
(2)此氯化钠溶液的溶质质量分数为0.9%,NaCl的含量达到了要求.
点评 本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
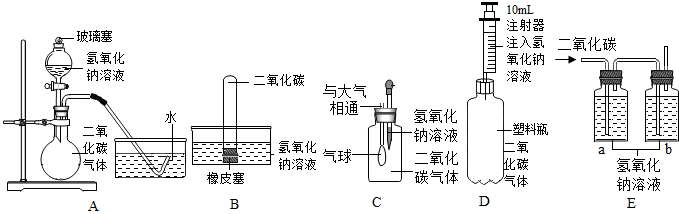
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
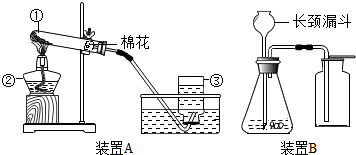 (1)写出指定的仪器名称
(1)写出指定的仪器名称查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
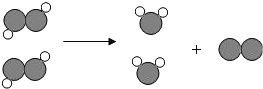 如图为某反应的微观示意图,不同的球代表不同元素的原子,有关说法中正确的是( )
如图为某反应的微观示意图,不同的球代表不同元素的原子,有关说法中正确的是( )| A. | 反应前有2种分子,反应后有3种分子 | |
| B. | 该反应基本类型为分解反应 | |
| C. | 该反应生成物都属于化合物 | |
| D. | 生成物分分子个数比为3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com