
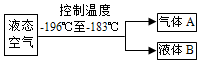
 如图,工业上常用分离液态空气制氧气和氮气(氧气的沸点是-183℃,氮气的沸点是-196℃).
如图,工业上常用分离液态空气制氧气和氮气(氧气的沸点是-183℃,氮气的沸点是-196℃). 分析 (1)根据工业上制取氧气的原理进行分析解答即可.
(2)呼吸时把空气中的氧气转化为二氧化碳,同时从体内带出水蒸汽,人体呼出气体中氧气的含量比空气中的低,结合空气中氧气约占21%,进行分析解答.
解答 解:(1)从液态空气分离氮气和氧气,利用的是它们的沸点不同;在压强101.3kPa条件下,液态氮沸点为-196℃,而液态氧的沸点为-183℃,当液态空气在压强101.3kPa条件下,从-196℃以下温度升高时,液态氮首先气化,氧气仍然是液体,于是就可得到的是气态氮和液态氧.
(2)呼吸时把空气中的氧气转化为二氧化碳,同时从体内带出水蒸汽,人体呼出气体中氧气的含量比空气中的低,空气中氧气约占21%,故人体呼出的气体中氧气的体积分数应小于21%,但不可能为0,故C选项符合要求.
答案:
(1)液态氧;(2)16%.
点评 本题难度不大,考查工业上制取氧气的原理,了解工业上制取氧气的原理、化学方程式的书写方法即可正确解答本题.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:初中化学 来源: 题型:选择题
| A. | X中有水 | B. | X是化合物 | C. | X由四种元素组成 | D. | X化学性质不稳定 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 1:9 | B. | 2:9 | C. | 16:9 | D. | 23:9 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
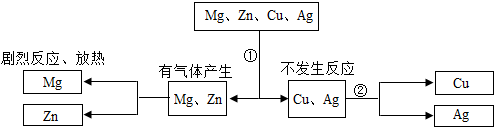 某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程:依据流程设计,下面对物质①②的选择合理的是( )
某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程:依据流程设计,下面对物质①②的选择合理的是( )| A. | ①稀硫酸②硝酸银 | B. | ①稀盐酸②硫酸锌 | ||
| C. | ①稀盐酸②硫酸亚铁 | D. | ①稀硫酸②氯化镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ”表示有可循环利用的物质)
”表示有可循环利用的物质)
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com