
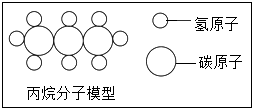
分析 (1)由丙烷的分子模型图,1个丙烷分子是由3个碳原子和8个氢原子构成的,进行分析解答.
(2)丙烷完全燃烧后生成水和二氧化碳,写出反应的化学方程式即可.
解答 解:(1)由丙烷的分子模型图,1个丙烷分子是由3个碳原子和8个氢原子构成的,其化学式为:C3H8.
(2)丙烷完全燃烧后生成水和二氧化碳,反应的化学方程式为:C3H8+5O2$\frac{\underline{\;点燃\;}}{\;}$4H2O+3CO2.
故答案为:(1)C3H8;(2)C3H8+5O2$\frac{\underline{\;点燃\;}}{\;}$4H2O+3CO2.
点评 本题难度不大,利用丙烷的分子模型图确定丙烷的化学式是正确解答本题的关键.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
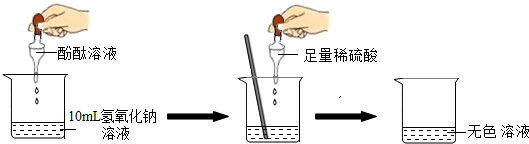
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
查看答案和解析>>
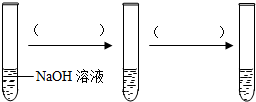
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 炒菜时油锅着火,立即盖上锅盖 | |
| B. | 高层住房着火时,立即打开所有门窗 | |
| C. | 厨房燃气管漏气,立即关闭阀门开窗通风 | |
| D. | 扑灭图书档案发生的火灾时最适宜用液态二氧化碳灭火器 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
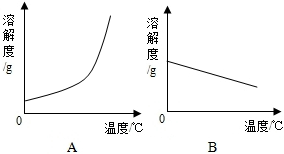
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com