


科目:初中化学 来源: 题型:
| A、NH4+、Mg2+、Cl-、Zn2+ |
| B、K+、Ba2+、OH-、NO3- |
| C、Mg2+、Cu2+、Cl-、SO42- |
| D、Na+、Cl-、Ba2+、SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
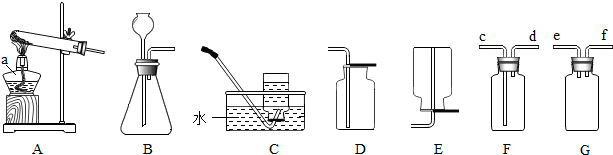
查看答案和解析>>
科目:初中化学 来源: 题型:
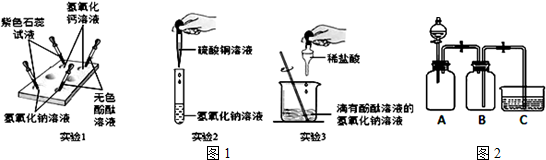
| 实验操作 | 实验现象 |
| 向两个充满SO2的200mL软塑料瓶中分别注入10mL水和10mL NaOH溶液,振荡,对比. | 两个瓶子变瘪的程度完全相同 |
| 实验操作 | 实验现象 |
利用如图所示装置进行实验:向两个充 满SO2的300mL集气瓶中分别加入6mL水和6mL NaOH溶液,一段时间后,打开止水夹,对比.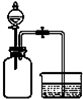 |
倒吸入两个集气瓶中 的液体体积完全相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com