
【题目】硬水受热后会产生水垢,水垢的主要成分是CaCO3和Mg(OH)2 , 其它成分不参与反应,实验室由水垢制取纯净CaCl2固体的流程如图: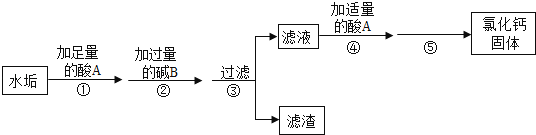
请按要求填空:
(1)酸A的名称是;
(2)步骤②中生成沉淀的化学反应方程式是;
(3)步骤④加足量酸A的作用是;
(4)步骤⑤是利用的方法得到氯化钙固体.
【答案】
(1)盐酸
(2)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
(3)将反应剩余的氢氧化钙除去
(4)蒸发结晶
【解析】解:(1)人体胃酸的主要成分是盐酸,所以酸A是盐酸,化学式为:HCl;(2)步骤②中生成沉淀的反应是氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;(3)前面加入的是过量的氢氧化钙,而最后要得到氯化钙,需要将氢氧化钙除去,所以步骤④加酸A的作用是将反应剩余的氢氧化钙除去;(4)滤液中加入盐酸反应后是盐酸和氯化钙的混合物,所以要从溶液中得到氯化钙,需要用蒸发结晶的方法.
故答案为:(1)HCl;(2)MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;(3)将反应剩余的氢氧化钙除去;(4)蒸发结晶
(1)根据人体胃酸的主要成分是盐酸,所以酸A是盐酸进行分析;(2)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,氢氧化钙溶液和氯化镁反应生成氢氧化镁白色沉淀和氯化钙进行分析;(3)根据需要制取的是氯化钙和加入的过量碱B进行分析;(4)根据滤液中加入酸A后的溶液成分进行分析


科目:初中化学 来源: 题型:
【题目】乙炔(C2H2)是生产聚氯乙烯的重要原料.用电石(主要成分为CaC2)与水反应可制取乙炔,最终还可得到电石渣.某电石渣中含氢氧化钙92.5%,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水.
(1)乙炔中碳、氢元素的质量比为 .
(2)100kg上述电石渣中氢氧化钙的质量为kg.
(3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质的命名不正确的是( )
A.Na2O-----氧化钠
B.Mg(OH)2------氢氧化镁
C.Na2CO3-----碳酸钠
D.FeCl2------氯化铁
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“创新”是一个民族的灵魂,是人类发展的不竭动力.
(1)“中国高铁”成了中国创新的一面旗帜,让世人瞩目,高速铁路离不开无缝钢轨,钢铁属于(填“单质”“合金”“复合材料”中的一项)
(2)“改进实验”也是化学实验中的创新,如图是小明同学在完成铁丝在氧气中燃烧的实验,请指出实验中的不足之处; , 写出铁丝在氧气中燃烧的化学方程式;
(3)我国计划在2020年建成自己的空间站,宇航员呼出的热气,分泌的汗水,潮湿抹布在干燥时产生的水汽,全部都会在空间站上安装的在升冷凝水系统中,转变成引用水,实现名副其实的水循环,水是生命之源,有关水的说法不正确的是(填选项序号)
①水是最常用的溶剂
②蒸馏水不含杂质,长期饮用有益健康
③水通电分解实验可证明化学反应中分子可分
④水在天然循环过程中发生了物理变化.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图实验,将针筒内温度相同的全部液体迅速注入容器中,实验内容如表所示.
实验编号 | 容器Ⅰ | 针筒Ⅰ | 容器Ⅱ | 针筒Ⅱ | 红墨水液面位置 |
a | 二氧化碳(充满且足量) | 5mL饱和澄清石灰水 | 二氧化碳(充满且足量) | 5mL较浓的氢氧化钠溶液 | 保持左低右高 |
b | 0.65g锌 | 15mL盐酸 | 0.24g镁 | 15mL盐酸 | 最终左右相平 |
(注:实验开始前红墨水左右两端液面保持相平,容器Ⅰ、Ⅱ体积相同,装置气密性良好)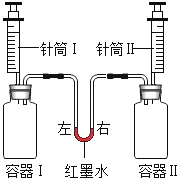
(1)实验a中,容器Ⅰ内开始时产生的现象是 , 红墨水液面位置变化的原因是 .
(2)实验b中,针筒内盐酸足量且溶质质量分数相同,开始时红墨水的位置变化是 , 其原因是 , 最后左右相平说明 , 请写出容器Ⅱ中反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com