
分析 (1)根据溶液稀释前后溶质的质量不变进行分析解答;
(2)根据Fe2O3的质量和反应的方程式、溶质的质量=溶液的质量×溶质的质量分数,可计算出反应的稀硫酸的质量.
解答 解:(1)溶液稀释前后溶质的质量不变,设需水的质量为x,
则有50g×98%=(50g+x)×10%,解得x=440g;
(2)铁锈中含纯净的氧化铁为:200g×80%=160g,
设需10%的稀硫酸的质量是y,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294
160g y×10%
$\frac{160}{160g}$=$\frac{294}{y×10%}$
y=2940g
答:(1)把50g质量分数为98%的浓硫酸,稀释成10%的稀硫酸,需要水的质量是440g;
(2)要使160g Fe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量2940g.
点评 溶液稀释前后溶质的质量不变,溶质的质量=溶液的质量×溶质的质量分数,并了解方程式计算的方法即可顺利解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 58 | X | 58 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
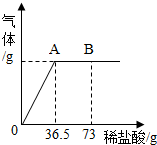 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
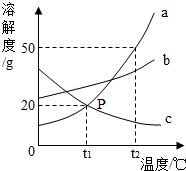 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com