
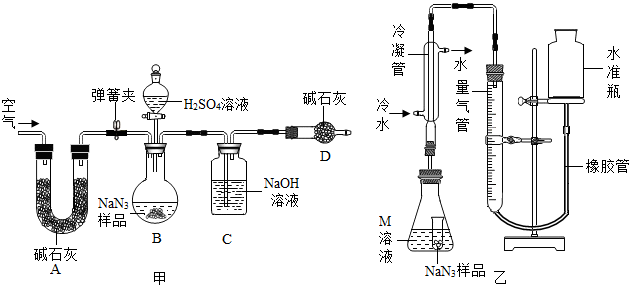
分析 (1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
解答 解:(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
故答案为:(1)2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
点评 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A | 安全常识 | B | 生活知识 |
| 瓦斯爆炸──天然气引起 煤气中毒──CO引起 | 硬水──可溶性的钙镁化合物含量高 蜂窝煤易于燃烧──与空气充分接触 | ||
| C | 物质的性质与用途 | D | 物质分类 |
| H2作高能燃料──可燃性 N2作保护气──化学性质不活泼 | 空气──混合物 河水──氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:| 物质 导电性 状态 | 食盐NaCl | 硝酸钾KNO3 | 蔗糖C12H22O18 | 氢氧化钠NaOH | 硫酸铜CuSO4 |
| 固态 | × | × | × | × | × |
| 熔化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com