(1)甲酸(HCOOH)的水溶液可溶解镁,反应式为:Mg+2HCOOH═(HCOO)2Mg+H2↑
请回答下列问题:
①计算甲酸分子中碳、氢、氧三种元素的质量之比.
②46g甲酸和多少克乙醇(C2H5OH)中的含碳量相等?
③4.8g镁和足量的甲酸溶液反应,最多能产生氢气多少L?(已知该状况下氢气的密度 为0.089g?L?)
(2)某工厂用质量分数为98%的浓硫酸(密度为1.84g?cm3)配制质量分数约为30%的稀硫酸供生产使用.配制时所用的浓硫酸与水的体积之比最接近________.(写出解题过程)
(3)已知NH4NO3和KH2PO4固体混合物中氮元素的质量分数为28%,计算该混合物中KH2PO4的质量分数为________.(写出解题过程)
解:(1)①根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得甲酸分子中碳、氢、氧三种元素的质量之比为 12:2:(16×2)=6:1:16;
答:甲酸分子中碳、氢、氧三种元素的质量之比为 6:1:16;
②设 46g甲酸和xg乙醇(C
2H
5OH)中的含碳量相等,
46×
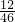
×100%=x×

×100%
解答 x=23 g;
答:46g甲酸和23克乙醇(C
2H
5OH)中的含碳量相等;
③设4.8g镁和足量的甲酸溶液反应,最多能产生氢气
Mg+2HCOOH═(HCOO)
2Mg+H
2↑
24 2
4.8g y

解答 y=0.4g,0.4g÷0.089g/L≈4.49L;
答:最多能产生氢气4.49L;
(2)根据溶质的质量分数=
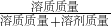
×100%,
设 需要98%的浓硫酸的体积为V
1,所需水的体积为V
2,

×100%=30%
解答 V
1:V
2=1:4;
故答案为 1:4;
(3)纯净NH
4NO
3中氮元素的质量分数为:

×100%=35%,
混合物中NH
4NO
3的质量分数为:
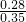
×100%=80%;
所以混合物中KH
2PO
4的质量分数为:1-80%=20%;
故答案为:20%.
分析:(1)①根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
②根据46g甲酸和乙醇(C
2H
5OH)中的含碳量相等,进行解答;
③根据镁和甲酸溶液反应方程式进行解答;
(2)根据溶质的质量分数=
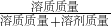
×100%,进行解答;
(3)根据混合物中NH
4NO
3中氮元素的质量分数为28%,求出其纯度,即可求混合物中KH
2PO
4的质量分数.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

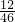 ×100%=x×
×100%=x× ×100%
×100% 
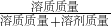 ×100%,
×100%, ×100%=30%
×100%=30%  ×100%=35%,
×100%=35%,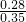 ×100%=80%;
×100%=80%;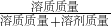 ×100%,进行解答;
×100%,进行解答;

 孟建平名校考卷系列答案
孟建平名校考卷系列答案