
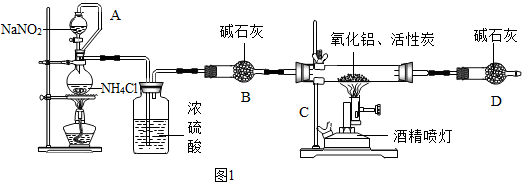

分析 (1)根据化合价代数和为零进行分析;
(2)根据加入药品前必须进行的操作是检查装置的气密性,饱和亚硝酸钠与氯化铵溶液反应放出热量,一氧化碳有毒不能直接排放进行分析;
(3)根据反应物中碳和氧化铝是固体分析解答;
(4)根据偏铝酸钠、二氧化碳和水反应生成氢氧化铝和碳酸钠进行分析;
(5)根据实验时,应该先检验装置的气密性,然后再加入药品进行分析;
(6)根据广口瓶中的试剂X的作用考虑;
(7)根据烧杯中物质增重3.4克,就是生成的氨气的质量,结合化学方程式进行计算;
(8)根据浓硫酸吸收氨气的效果比稀硫酸好进行分析.
解答 解:(1)化合价代数和为零,氮化铝(AlN)中铝元素显示+3价,所以氮元素的化合价是-3;
(2)加入药品前必须进行的操作是检查装置的气密性;饱和亚硝酸钠与氯化铵溶液反应放出热量;一氧化碳有毒不能直接排放,需要尾气处理;
(3)反应物中碳和氧化铝是固体,可能混入产物中,所以氮化铝产品中的杂质除氧化铝之外,还可能含有C;
(4)偏铝酸钠、二氧化碳和水反应生成氢氧化铝和碳酸钠,所以小亮的结论不正确;
(5)实验时,应该先检验装置的气密性,然后再加入药品,所以正确的操作顺序为:cabd;
(6)广口瓶中的试剂X的作用是将氨气与水隔开,因为氨气极易溶于水,要用四氯化碳将氨气与水隔开,水不溶于四氯化碳,故选:B;
(7)烧杯中物质增重3.4克,就是生成的氨气的质量,
设样品中AlN的质量为x
AlN+NaOH+H2O=NaAlO2+NH3↑
41 17
x 3.4g
$\frac{41}{x}$=$\frac{17}{3.4g}$
x=8.2g
所以样品中AlN的质量分数为:$\frac{8.2g}{10g}$×100%=82%;
(8)装置测得的结果偏低是因为生成的氨气会残留在集气瓶内,导致不能被硫酸充分吸收.讲稀硫酸换成浓硫酸一方面没有意义,另一方面还会导致浓硫酸吸收空气中的水蒸气使得测量结果偏大,可采取的措施是:反应结束后,向烧瓶内继续加入足量的氢氧化钠溶液,使装置内残留气体排出,被烧杯中的硫酸充分吸收.
故答案为:(1)-3;
(2)检验装置的气密性;该反应属于放热反应;没有尾气处理装置;
(3)C;
(4)不正确,偏铝酸钠和二氧化碳反应也会生成氢氧化铝沉淀;
(5)cabd;
(6)B;
(7)82%;
(8)反应结束后,向烧瓶内继续加入足量的氢氧化钠溶液,使装置内残留气体排出,被烧杯中的硫酸充分吸收.
点评 解答本题要知道制取气体的一般步骤,知道用排水法测定气体体积的方法,由于氨气极易溶于水,要用植物油将氨气与水分开;知道代入方程式计算的数值只能是质量,必须把体积换算成质量再进行列比例式计算.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 实验事实 | 实验结论 |
| A | 某气体能使燃着的木条熄灭 | 该气体一定是二氧化碳 |
| B | 常温下,测得某溶液的pH=10 | 该溶液一定呈碱性 |
| C | 溶液具有均一、稳定的特征 | 均一、稳定的液体一定是溶液 |
| D | 某物质可以导电 | 该物质一定是石墨 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用水灭火,目的是降低可燃物的着火点 | |
| B. | 在化石燃料中,天然气是比较清洁的燃料 | |
| C. | 有发光、放热现象的一定是燃烧 | |
| D. | 石油、乙醇均是可再生资源 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物理性质 | B. | 制法 | C. | 用途 | D. | 化学性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 棉、羊毛,塑料等都属于天然有机高分子材料 | |
| B. | 食用加碘食盐和强化铁酱油可补充某些人体必需微量元素 | |
| C. | 用甲醛水溶液浸泡水产品以防止腐烂 | |
| D. | 铁制品表面涂“银粉(铝粉)”防生绣,是由于铝的化学性质比铁稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com