
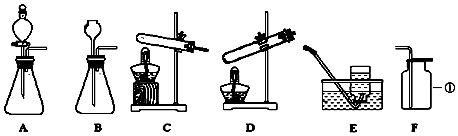
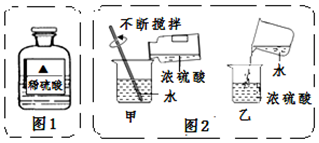
分析 集气瓶是收集气体的仪器,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.稀释浓硫酸时,应该把浓硫酸慢慢注入水中,并不断搅拌,使产生的热及时散失出去;有关溶液的计算和化学方程式的计算要准确.
解答 解:Ⅰ(1)集气瓶是收集气体的仪器,故答案为:集气瓶;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;故答案为:2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑; C;棉花;将带火星的小木条放在集气瓶口处,木条复燃,证明已经集满氧气;
(3)实验室没有大理石和石灰石,只有碳酸钠粉末和稀盐酸,为了顺利制取一瓶CO2气体,应选择最佳的装置组合是AF,选择该气体发生装置的理由是:固体与液体在常温下反应,且能控制反应速率;故答案为:AF(有漏或错不得分);固体与液体在常温下反应,且能控制反应速率;
Ⅱ(1)设需要98%的浓硫酸的质量为m,m•98%=49g×20%,m=10g,故答案为:10;
(2)如图1所示,把配制好的溶液装入试剂瓶中,贴上标签,则标签上的空白处应填写的是质量分数20%,故答案为:20%;
(3)稀释浓硫酸时,应该把浓硫酸慢慢注入水中,并不断搅拌,使产生的热及时散失出去;故答案为:甲;
(4)设20g合金中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
x 49g×20% $\frac{65}{98}=\frac{x}{49g×20%}$ x=6.5g
$\frac{20g-6.5g}{20g}$×100%=67.5%;
答:锌铜合金中铜的质量分数为67.5%;
故答案为:67.5%;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的验满和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:初中化学 来源: 题型:选择题
| A. | 熟石灰即氢氧化钙,它的化学式为CaOH | |
| B. | 消毒剂:三氯异氰尿酸(C3O3N3Cl3),由三氯异氰尿酸分子构成,其一个分子中有12个原子 | |
| C. | 过氧化氢(H2O2)中,氢元素为+1价,氧元素为-2价 | |
| D. | 蓝色的消毒液中含有硫酸铜,这里“铜”指的是金属铜,“硫酸”指的是一种酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 根据如图A、B、C三种固体的溶解度曲线回答:(A、B、C析出晶体时均不含结晶水)
根据如图A、B、C三种固体的溶解度曲线回答:(A、B、C析出晶体时均不含结晶水)查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SO2是组成空气的主要气体之一 | |
| B. | SO2分子中含有氧分子 | |
| C. | SO2中硫元素和氧元素的质量比为1:2 | |
| D. | SO2中硫元素的质量分数为50% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )| A. | t1℃时,三种固体物质的溶解度关系为乙>甲>丙 | |
| B. | t2℃100g甲物质饱和溶液中含有60g甲 | |
| C. | 将丙物质饱和溶液变为不饱和溶液,可采用升温的方法 | |
| D. | t2℃时分别用100g水配制甲、乙的饱和溶液,降温到t1℃,析出固体的质量甲>乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 中子数为6 | B. | 质子数为6 | ||
| C. | 电子数为6 | D. | 质子数和中子数之和是14 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com