
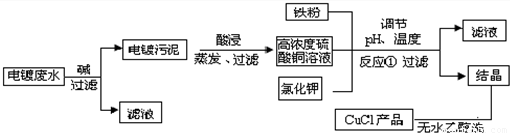
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:
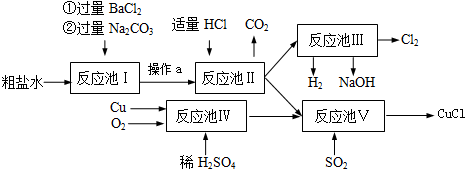
查看答案和解析>>
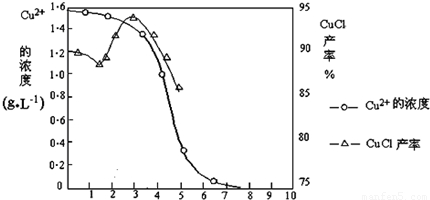
科目:初中化学 来源: 题型:阅读理解
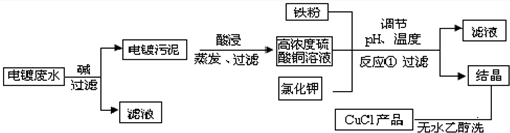
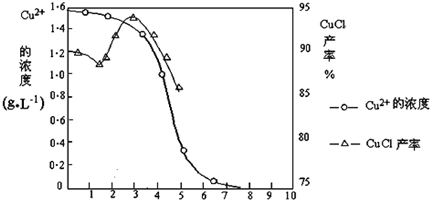
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 2010诺贝尔化学奖得主为美国科学家理查德?海克(RichardF.Heck),伊智根岸(Ei-ichiNegishi)和日本科学家铃木彰(AkiraSuzuki)因在有机合成领域中钯催化交叉偶联反应方面的卓越研究获奖.钯催化的交叉偶联是今天的化学家所拥有的最为先进的工具.元素周期表中钯元素的信息如图所示,对图中信息理解错误的是( )
2010诺贝尔化学奖得主为美国科学家理查德?海克(RichardF.Heck),伊智根岸(Ei-ichiNegishi)和日本科学家铃木彰(AkiraSuzuki)因在有机合成领域中钯催化交叉偶联反应方面的卓越研究获奖.钯催化的交叉偶联是今天的化学家所拥有的最为先进的工具.元素周期表中钯元素的信息如图所示,对图中信息理解错误的是( )查看答案和解析>>
科目:初中化学 来源: 题型:解答题
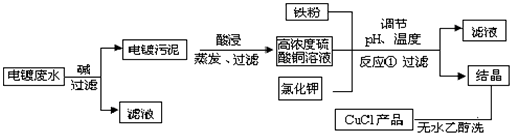
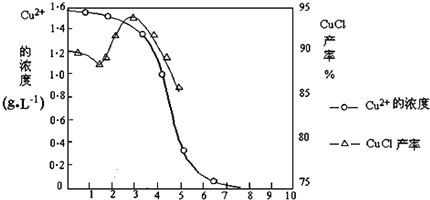
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com