
【题目】如图所示,在6支试管中分别低价2滴紫色石蕊溶液。(资料:KCl溶液、CaCl2溶液均显中性)
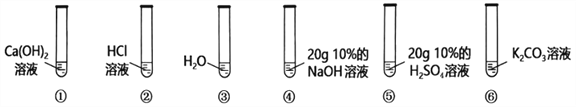
(1)作为对照试验的是试管__________(选填①~⑥编号)。
(2)试管②、⑤溶液变为红色,其原因是溶液中溶质都含有________元素。
(3)试管⑥中溶液变为蓝色,说明碳酸钾溶液显________(选填“酸性”、“中性”或“碱性”)。碳酸钾属于________(填物质类别),可做________肥使用,取该溶液灼烧,透过蓝色钴玻璃火焰呈________色。
(4)将试管⑤倒入试管④中,写出该反应的化学方程式________________________________。
充分反应后溶液呈现________________。
A.红色 B.紫色 C.蓝色
(5)实验后将试管①②⑥中的废液倒入大烧杯中,最终得到红色溶液,则大烧杯的废液中除了石蕊外,一定还含有________________________________。
【答案】 ③ H 碱性 盐 钾 紫 H2SO4 + 2NaOH →Na2SO4 + 2H2O C CaCl2、KCl、HCl
【解析】(1)水是几种溶液的溶剂,故用水做对比实验;
(2)盐酸和硫酸的水溶液中都能电离出氢离子,故都能使石蕊溶液变为红色;
(3)石蕊遇碱变蓝,故说明碳酸钾溶液显碱性;碳酸钾是由金属离子和酸根离子构成的,故是盐;碳酸钾中含有有钾元素,故可以做氮肥;钾的焰色反应呈紫色;
(4)氢氧化钠与稀硫酸反应生成硫酸钠和水,反应方程式为H2SO4 + 2NaOH →Na2SO4 + 2H2O;80份质量的氢氧化钠和98份质量的硫酸恰好完全反应,故题中氢氧化钠有剩余,故溶液变为蓝色,故选C;
(5)将氢氧化钙、稀盐酸、碳酸钾倒入同一废液烧杯中后,溶液显红色,说明盐酸有剩余,故氢氧化钙和碳酸钾已经完全反应,故溶液中的溶质有盐酸、氯化钾、氯化钙;


科目:初中化学 来源: 题型:
【题目】镓(元素符号为Ga)原子的结构示意图如图所示: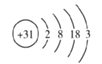 ,则镓元素属于_____(填“金属”或“非金属”)元素。在化学反应中镓原子与铝原子的性质相似,原因是_______________。写出氢氧化镓和稀盐酸反应的化学方程式______________。
,则镓元素属于_____(填“金属”或“非金属”)元素。在化学反应中镓原子与铝原子的性质相似,原因是_______________。写出氢氧化镓和稀盐酸反应的化学方程式______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
溶解度 (g/100GH20) | NaCl | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.0 | 39.8 |
MgSO4 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 | |
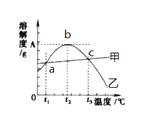
请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在学习酸碱的化学性质时构建了如图知识网,A、B、C、D 是不同类 别的化合物。请回答:反应①的化学方程式为_________; 反应②后生成蓝色溶液,则 B 的化学式为_____;反应④可用于制取 烧碱,化学方程式为______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验一:电子天平AB的表面皿中分别盛有浓HCl、浓H2SO4,放置一段时间。
(1)A中的示数变小,原因是____________________________________。
(2)与图C所示变化相一致的是_______________(选填“A”或“B”)
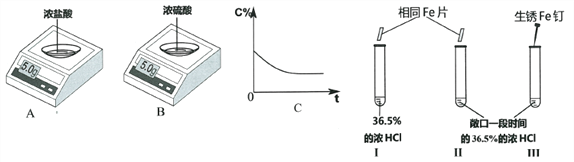
实验二:做对比实验,得出相应结论。
(3)I和II试管中都产生气泡,且I中比II中剧烈。此现象说明物质反应的快慢与_______________有关。
III试管中可能的现象是____________________________________。
请用化学方程式解释其原因_________________、___________________。
(4)如图所示,比较金属的活动性大小。实验现象:试管IV比试管V中产生气泡剧烈。得出结论:金属活动性X>Y。我不赞同此结论,理由是____________________________________。完成本实验需要控制的变量是____________________________________。
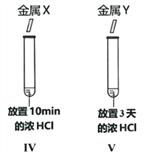
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下列提供的仪器装置回答问题:
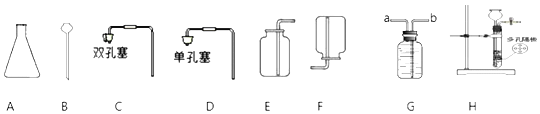
①仪器名称:A为_____
②小丽用双氧水和二氧化锰制取氧气时,发现反应速率过快,小丽思考后将所用仪器B改为_____,该反应的化学方程式为_____,若使用装置G收集氧气,氧气应从_____(填“a”或“b”)端通入。
③小明选用A到G中仪器,组装出实验室制取二氧化碳装置,他所选仪器有_____(填写一套即可),反应的化学方程式为_____。
④小刚选用H装置放入锌粒和稀硫酸制取氢气,H装置的优点是_____,反应一段时间后他关闭活塞,发现装置中固液无法分离,原因可能为_____(写出一种即可);
⑤小刚用制得的氢气还原氧化铜,得到0.1mol铜,则理论上参与反应的氢气的质量为_____(根据化学方程式计算)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为A、B两种固体物质的溶解度曲线。
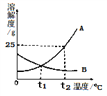
(1)t2℃时,100g水中溶解___gA物质恰好饱和,该饱和溶液中溶质的质量分数为_____。
(2)t2℃时,分别将恰好饱和的A、B两种物质的溶降温至t1℃,溶质的质量分数保持不变的是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下图所示装置探究碳的氧化物的性质(固定装置略)。
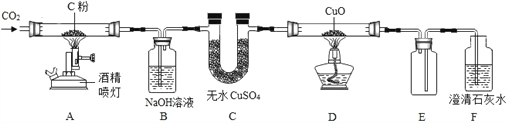
① 装置 A 中发生反应的化学方程式__________;装置 B 的作用是______; 装置 C 中的现象是______。
② 装置 D 玻璃管中发生反应的化学方程式______ ,该反应中_________具有还原性。
③ 装置 E 的作用是________ ,本实验还应在装置______之间添加装置 E。
④ 从保护环境的角度分析,本实验的不足是__________。
⑤ 从微观角度分析 CO2 与 CO 化学性质不同的原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.
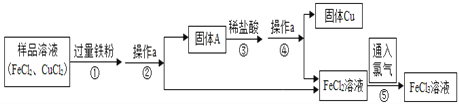
(1)写出步骤①中发生反应的化学方程式是_________.
(2)步骤②中的操作a的名称是___;
(3)固体A的成分是_____________.(填化学式)
(4)步骤⑤反应的基本类型是________,
(5) FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用____(用字母表示)最合理。
A.稀硝酸 B .稀硫酸 C .稀盐酸 D .稀醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com