将18.4g NaOH和NaHCO3的混合物在密闭的容器中加热到约250℃,经充分反应排出气体,冷却,称量所得固体质量为16.6g.则原混合物中NaOH的质量分数是多少?
【答案】
分析:首先分析反应原理:因为实在密闭容器中进行反应,所以存在过量问题,因为二者可以发生反应NaOH+NaHCO
3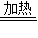
Na
2CO
3+H
2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
所以解答此题首先要通过恰好反应来判断是否过量,确定反应方向,然后再根据化学方程式,利用少量物质的质量去进行解答.
解答:解:由于已知反应前混合物的质量和反应后固体的质量,所以,有可能存在过量问题.
设18.4g混合物正好完全反应,减少的质量为x.
NaOH+NaHCO
3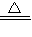
Na
2CO
3+H
2O
124 18
18.4g x
x=
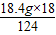
=2.7g
因2.7g>(18.4-16.6)g所以氢氧化钠过量,碳酸氢钠完全反应.
NaOH+NaHCO
3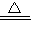
Na
2CO
3+H
2O
84 18
m(NaHCO
3) (18.4-16.6)g
m(NaHCO
3)=
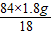
=8.4g
m(NaOH)=18.4g-8.4g=10g
w(NaOH)=
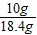
×100%=54.3%
答:原混合物中NaOH的质量分数为54.3%.
点评:本题难度很大,一是判断反应过量问题,二是怎样判断过量.
在判断过量中为什么2.7g>(18.4g-16.6g),就判断为氢氧化钠过量呢?
因为若是碳酸氢钠过量,就会继续分解,固体质量继续减少,和题意不符.

 Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应.
Na2CO3+H2O,反应就有三种情况,一是恰好反应完全,二是氢氧化钠过量,还是这个反应,三是碳酸氢钠过量,剩余的碳酸氢钠还要发生分解反应. Na2CO3+H2O
Na2CO3+H2O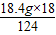 =2.7g
=2.7g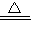 Na2CO3+H2O
Na2CO3+H2O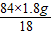 =8.4g
=8.4g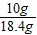 ×100%=54.3%
×100%=54.3% 
