


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
 (2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.
(2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.| 实验编号 | 锌的质量 | 足量稀硫酸的浓度 | 时间 | 生成氢气的体积 |
| 实验一 | 1.3g | 5% | 169分钟 | 448mL |
| 实验二 | 1.3g | 10% | 66分钟 | 448mL |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) | 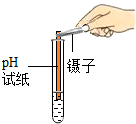 |
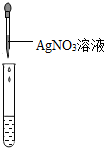 |
 |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
| 要分离的盐 | 所用试剂 | 主要操作 |
CaCl2、NaCl CaCl2、NaCl |
Na2CO3,HCl Na2CO3,HCl |
混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com