
| 实验步骤 | 预计实验现象 | 预计实验结论 |
| |
猜想②正确 | |
| 猜想③正确 |
| 实验步骤 | 预计实验现象 | 预计实验结论 |
| 从烧杯中取少量反应后的溶液 于试管中,滴入1~2滴紫色石 蕊溶液,振荡 |
紫色石蕊溶液不变色 | 猜想②正确 |
| 紫色石蕊溶液变红 | 猜想③正确 |
| 实验步骤 | 预计实验现象 | 预计实验结论 |
| 从烧杯中取少量反应后的溶液 于试管中,滴入1~2滴紫色石 蕊溶液,振荡 |
紫色石蕊溶液不变色 | 猜想②正确 |
| 紫色石蕊溶液变红 | 猜想③正确 |


科目:初中化学 来源: 题型:
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
| A、根据金属表面的现象判断三种金属的活动性为:Mg>Ti>Cu |
| B、若Ti粉中混有Mg,提纯Ti时可用稀盐酸除去Mg |
| C、用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径 |
| D、Ti和Mg的活动性比Cu强 |
查看答案和解析>>
科目:初中化学 来源: 题型:
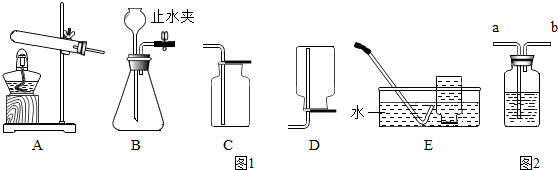
查看答案和解析>>
科目:初中化学 来源: 题型:
 人体缺乏维生素C(简写Vc)就会患坏血病.如图为某种“维生素C”说明书的一部分,请回答:
人体缺乏维生素C(简写Vc)就会患坏血病.如图为某种“维生素C”说明书的一部分,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
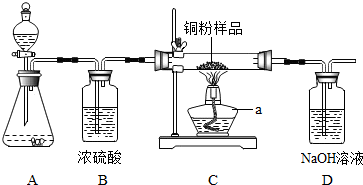
| 实验方案 | 实验现象 | 分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL 5%H2O2溶液的试管. | 带火星木条不复燃 | H202溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H202溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管.观察现象.待反应结束后将试管里的剩余物进行 | 称得固体质量为1g. | 猜想Ⅰ成立.反应前后氧化铜的质量相等. |
| 实验三:向盛有5mL5%H202溶液的试管中加入1g | 没有气泡产生,带火星 木条不复燃. | 猜想Ⅱ |
查看答案和解析>>
科目:初中化学 来源: 题型:
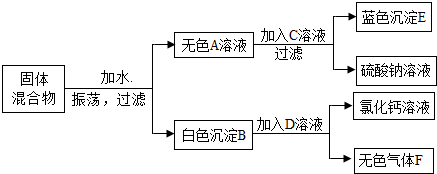
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com