
 温度 温度 溶解度 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ① | —— | —— | —— |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | —— |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
|
|
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 

科目:初中化学 来源:不详 题型:计算题
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| | 甲 | 乙 | 丙 |
| 金属混合物质量/g | 10 | 10 | 20 |
| 稀硫酸质量/g | 100 | 120 | 100 |
| 剩余固体质量/g | 4 | 4 | 13 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
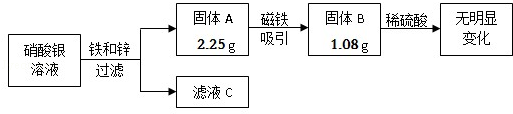
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com