
人体内的一些液体正常pH范围如下,其中呈酸性的是
A. 血浆7.35-7.45 B. 胆汁7.1-7.3
C. 胃液0.9-1.5 D. 胰液7.5-8.0
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:河南省濮阳市2018届九年级上学期第一次月考化学试卷 题型:单选题
某温度时,向一定量的饱和石灰水中加入少量的生石灰,恢复到原来的温度.下列说法中正确的是( )
A. 溶液的质量减少 B. 溶液的质量不变
C. 溶剂的质量不变 D. 溶质质量增大
查看答案和解析>>
科目:初中化学 来源:广东省广州市从化区2019届九年级下学期中考调研测化学试卷 题型:实验题
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
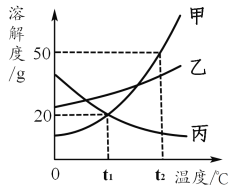
(1)气体的溶解度随温度变化的情况与______(填“甲”、“乙”或“丙”)相似。
(2)t2℃时,将65g甲固体加入到100g水中,充分溶解并 恢复到原温度后,得到溶液的质量为________g。
(3)要使接近饱和的乙溶液变为饱和溶液,可采用的一种方法是________。
(4)若将t2℃时甲的饱和溶液降温到t1℃,则其溶液的溶质质量分数会________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源:广东省广州市从化区2019届九年级下学期中考调研测化学试卷 题型:单选题
下列各图中“〇”、“●”分别表示不同元素的原子,则其中表示化合物的是( )
A. 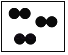 B.
B. 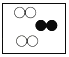 C.
C. 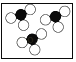 D.
D. 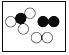
查看答案和解析>>
科目:初中化学 来源:广东省广州市从化区2019届九年级下学期中考调研测化学试卷 题型:单选题
下列有关实验现象的描述正确的是
A. 硫在空气中燃烧,发出蓝紫色火焰
B. 红磷在空气中燃烧,产生白色烟雾
C. 把打磨过的铝丝放入硫酸铜溶液中,铝表面出现红色物质,溶液由蓝色变为无色
D. 电解水实验中,正、负极两端玻璃管内收集到的气体体积比为2:1
查看答案和解析>>
科目:初中化学 来源:安徽省宿州市泗县2019届九年级下学期中考一模化学试卷 题型:科学探究题
某化学兴趣小组同学了解氯气(Cl2)是黄绿色气体,它的水溶液叫氯水。当同学们把紫色石蕊溶液加到氯水中,发现溶液先变红,后褪色。
(查阅资料)
(1)氯气溶于水,部分以C12分子存在于溶液中,部分与水反应C12+H2O=HCl+HClO。
(2)次氯酸(HCl)是一种弱酸,具有强氧化性,见光易分解。其反应方程式为:2HClO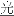 2HCl+O2↑
2HCl+O2↑
(现象分析)使紫色石蕊溶液变红的物质是氯水中的盐酸和______。
(提出问题)使紫色石蕊溶液褪色的物质是什么呢?
(提出猜想)
猜想1:氯水中的水使紫色石蕊褪色;
猜想2:氯水中的______使紫色石蕊褪色;
猜想3:氯水中的盐酸使紫色石蕊褪色;
猜想4:氯水中的次氯酸使紫色石蕊褪色。
(实验探究)取四朵用石蕊溶液染成紫色的干燥的纸花进行以下实验。
实验操作 | 实现现象 | 实验结论 |
①第一朵纸花喷水 | ①没有明显变化 | 猜想1 ______ |
②第二朵纸花直接放入盛有干燥的 ______ 集气瓶 | ②没有明显变化 | 猜想2不成立 |
第三朵纸花喷上稀盐酸 | ③变红,但 ______ | 猜想3不成立 |
④第四朵纸花喷上水后, ______ | ④先变红,后褪色 | 猜想4 ______ |
(拓展探究)实验室中保存氯水的方法是______。
(反思与评论)
兴趣小组同学想继续探究盐酸中的哪一种粒子使紫色石蕊溶液变红,设计如下实验方案:取少量盐酸于试管中,滴入几滴紫色石蕊溶液,再用滴管慢慢滴加氢氧化钠溶液,并不断搅拌,至红色消失。说明水分子和______(填化学符号)不能使石蕊变红。
请你设计其他实验方案探究验证:
实验操作 | 实验现象 | 实验结论 |
______ | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源:福建省宁德市毕业班中考二模化学试卷 题型:科学探究题
《天工开物》中记载的“倭铅”即是金属锌,说明我国炼锌在明代就出现。
探究一 用锌制取氢气甲同学拟用如图实验装置完成制取氢气和测量生成气体体积实验:
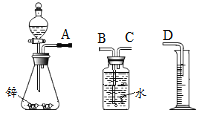
(1)写出锌与稀硫酸反应的化学方程式____。
(2)装置连接顺序是:A→___ →___→D(填字母)。
探究二 硫酸铜对氢气生成速率的影响
乙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为此展开探究。
(设计实验)
在锥形瓶中分别放入足量的、等质量的、颗粒大小相同的锌粒,再向分液漏斗中加入由31.5%的稀硫酸,不同体积水、5%的硫酸铜溶液组成的混合液,试剂用量记录如下表:
混合液(试管编号) | ① | ② | ③ | ④ | ⑤ |
31.5%的H2SO4溶液/mL | 10 | V1 | 10 | 10 | 10 |
5%的CuSO4溶液/mL | 3.6 | 3.8 | 4.0 | 4.2 | 4.4 |
蒸馏水/mL | 16.4 | 16.2 | 16.0 | 15.8 | V2 |
收集70mL水所用时间/s | 21.20 | 20.45 | 19.69 | 20.49 | 21.33 |
(3)表中的V1=____mL,V2=____mL。
(分析与结论)
(4)表中____组反应速率最快,原混合液中H2SO4和CuSO4溶质质量比为____(最简整数比)。(提示:31.5%的H2SO4溶液和5%的CuSO4溶液密度均为1.2g/mL)。
探究三 锌与硫酸铜溶液反应
丙同学取打磨过的锌片按下表内容进行对比实验:
实验 项目 | 硫酸铜溶液 溶质质量分数 | 是否 添加稀硫酸 | 锌表面产生的现象 |
① | 1.6% | 否 | 黑色物质 |
② | 1.6% | 加2滴 | 红色物质,有极少量的气泡 |
③ | 8% | 否 | 红褐色物质 |
④ | 8% | 加2滴 | 光亮红色物质,有少量的气泡 |
⑤ | 16% | 否 | 红色物质,有极少量的气泡 |
⑥ | 16% | 加2滴 | 光亮红色物质,有较多气泡 |
(分析与结论)
(5)锌与硫酸铜溶液反应要产生红色的物质,需要的条件是___。
(6)根据第⑤组实验判断,硫酸铜溶液可能显___(选填:“酸”、“碱”或“ 中”)性。
查看答案和解析>>
科目:初中化学 来源:江苏省无锡市2019届九年级下学期中考一模化学试卷 题型:综合题
过氧化钙晶体(CaO2•xH2O)是优良的供氧剂,受热会逐渐失水,120℃时完全分解为CaO2,350℃时CaO2迅速分解为CaO和O2。
(一)(性质探究)取少量CaO2于试管中加过量稀盐酸,无气泡产生;再加少量MnO2粉末,产生大量气泡。静置、取上层清液,逐渐加入碳酸钠溶液,先产生大量气泡,再出现白色沉淀。
⑴CaO2和盐酸发生复分解反应的化学方程式为___。
⑵加入碳酸钠溶液,产生的气体是___;出现白色沉淀,说明上层清液中含___。
(二)(制备流程)
方法1:由Ca(OH)2为原料制备CaO2•8H2O流程如下:

陈化:让初生晶体和母液放置一段时间,使晶体由小长大。
⑴将反应2及陈化的化学方程式补充完整:CaCl2+H2O2+2NH3•H2O+6___=CaO2•8H2O↓+2NH4Cl
⑵检验固体是否洗净的方法是:___。
⑶制备过程中除水外可循环使用的物质是:___(填化学式)。
方法2:由鸡蛋壳(含较多CaCO3)为原料制备CaO2•8H2O流程如下:
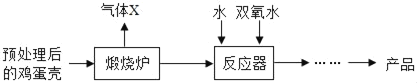
⑷反应器中由化合反应生成CaO2•8H2O,反应化学方程式为:___。
⑸在反应器中,应___。
①先加水冷却后再加双氧水 ②先加双氧水冷却后再加水
⑹若煅烧充分,则获得的CaO2•8H2O中还含有的固体杂质是___(填化学式)。
⑺“绿色化学”是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2•8H2O
的反应符合“绿色化学”的是___(填“方法1”或“方法2”)。
(三)(组成测定)若所得产品为CaO2•xH2O,下列装置可测定该产品的组成(样品中的杂质受热不反应)。
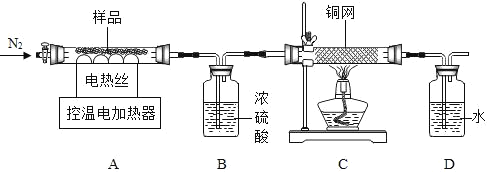
⑴实验前先缓慢通N2一段时间,控温将样品加热到350℃至CaO2分解完全;继续缓慢通N2,其目的是___(答一点即可)。
⑵装置B作用是___(填序号)
①测定产生的H2O质量 ②便于观察和控制气流速度
⑶若2.7g样品,加热到350℃至CaO2分解完全,测得B装置重1.44g、C中铜网增重0.16g。则x=___。
(反思)若先加热A,后加热C装置,测得x值___(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com